D amino asitler
D -amino asitler sınıfıdır amino asit olup, burada fonksiyonel gruplar, - karboksi (-COOH) ve amino (= NH 2 ) - α-konumunda olarak D - konfigürasyonu mevcut. Bunlar ayna görüntüsü izomerleri L -amino asitler.
D- amino asitler, bilinen tüm biyolojik sistemlerde , 23 proteinojenik amino asit formunda yaşamın önemli yapı taşları olan L - izomerlerinden çok daha az temsil edilir . Bu nedenle uzun bir süre boyunca D- amino asitlerin hiçbir biyolojik işlevi olmadığı ve "doğal olmadığı" varsayıldı . Bu resim 1990'ların başından beri değişti. Günümüzde örneğin bakteriler tarafından üretilen peptit antibiyotiklerde ve pirinç, sarımsak ve bezelye gibi çeşitli bitkilerde D- amino asitlerin bulunduğunu biliyoruz .
Bazı D amino asitleri de insanlarda önemli fizyolojik işlevleri yerine getirir . Özellikle merkezi sinir sisteminde bunlar D - serin ve D - aspartik asittir . D- amino asitlerin şizofreni gibi bazı hastalıklarda da rol oynadığı görülüyor . Bu araştırma alanı nispeten yenidir ve serbest D- amino asitlerin ve peptitlere veya proteinlere bağlananların birçok işlevi hala büyük ölçüde bilinmemektedir veya anlaşılamamıştır.
Kromatografik analiz yöntemleri yardımıyla, birçok gıda ve organizmada D- amino asitler tespit edilebilmiştir . Buradaki uygulamalardan biri , fosillerin yaşını belirlemek için amino asit tarihlemesidir .
Bilimin mevcut durumuna göre, günlük olarak gıda ile alınan miktarlarda serbest D- amino asitler insanlara zararsızdır. Teknik olarak üretilen D- amino asitler (yarı) sentetik antibiyotiklerin üretimi için yapı taşları olarak kullanılır ve çok sayıda başka ilacın kimyasal olarak bağlı bileşenleridir .
Temel bilgiler
kiralite

En basit amino asit olan glisin hariç , tüm proteinojenik amino asitler , dört farklı atom veya atom grubu ( ikame ediciler ) taşıyan en az bir karbon atomuna sahiptir . Mekansal olarak bakıldığında, bu ikameler bir tetrahedronun dört köşesini işgal eder . Bu düzenleme , ikame edicilerin hizalanması için iki farklı olasılık ile sonuçlanan bir asimetriye neden olur . Enantiyomerler veya ayna görüntüsü izomerleri olarak adlandırılan bu iki form, bir görüntü ve bir ayna görüntüsü gibi davranır. Asimetrik karbon atomu, sözde stereomerkezi oluşturur . Enantiyomerlerin görüntüsü ve ayna görüntüsü çakışamaz. Bu, dönen bir ayna eksenine sahip olmayan günlük hayattaki nesneler için de geçerlidir . Eller buna bir örnektir. Sol ve sağ eller bir görüntü ve ayna görüntüsü gibidir, ancak hizaya getirilemezler. Sağ ve sol el arasındaki farklar, diğer kiral (Yunanca 'el' kelimesi) sistemlerle etkileşime girdiklerinde özellikle belirginleşir . Örneğin, bir sağ el ikinci bir sağ veya sol eli salladığında veya "yanlış" eldiveni giymeye çalıştığında. Kiral ortamlarda moleküler enantiyomerlerdeki farklılıklar da belirgindir.
Alman Nobel Kimya Ödülü Sahibi Emil Fischer , kiral bir kimyasal bileşiğin uzamsal yapısının iki boyutta net bir şekilde haritalanabileceği bir projeksiyon yöntemi olan Fischer projeksiyonu geliştirdi . Bir referans madde ( gliseraldehit ) seçti . Fischer izdüşümünün kurallarına göre, asit grubu ( karboksi grubu ) her zaman yukarıya, amino asitleri ayırt eden kalıntı R ise her zaman aşağıya çekilir. Eğer bir amino grubu olduğu , bu çıkıntı soldaki yöntemi ( lat. Laevus ), bir bir söz L -amino asit. Küçük büyük harflerle amino asit adının önüne L harfi konur ; örneğin L - serin . Amino grubu Fischer projeksiyonunda sağ taraftaysa (Latince: dexter = 'sağ'), o zaman bir D- amino asittir. Sol ve sağ sıfatlar yalnızca Fischer projeksiyonuna göre gösterilen konfigürasyonla ilgilidir .
Gelen açısından kendi fiziksel özellikleri gibi, erime noktası , yoğunluk , çözünürlük , su ve diğer çözücüler ve izoelektrik noktası , D ve - L - amino asitler, tamamen aynıdır. Aşiral bir ortamda, yani başka hiçbir kiral molekülün bulunmadığı bir ortamda bile, bir istisna dışında aynı şekilde davranırlar: iki enantiyomer, aynı koşullar altında (konsantrasyon, sıcaklık, pH değeri) lineer polarize ışığın polarizasyon düzlemini döndürür. , Çözücüler vb.) katkı açısından aynı, ancak farklı yönlerde. Işığı saat yönünde çevirirseniz, saat yönünde veya (+) - şekli olarak adlandırılır. Saat yönünün tersine dönüş şekline sola dönüş veya (-) şekli denir. Amino asitlerin dönme duyusu ve yönü, günlük pratikte pek rol oynamaz. Yapılandırması - D - veya L çok daha önemlidir . Bir amino asidin (sol veya sağ) dönüş yönü, amino asidin konfigürasyonundan tamamen bağımsızdır. Bu, literatürde sıklıkla yanlış ifade edilmektedir. L- amino asitlere atıfta bulunulurken sıklıkla "sola-döner amino asitler" terimi kullanılır . Aslında, dönüş yönü ve dönüş yönü, büyük ölçüde dış ortama bağlıdır. Örneğin, amino asit L - lösin, altı molar hidroklorik asitte oda sıcaklığında + 15.1 ° (= saat yönünün tersine) belirli bir dönüş açısına ve nötr suda −10.8 ° (= saat yönünde) belirli bir dönüş açısına sahiptir. Olarak 3 mol kostik soda , diğer taraftan, bu yönünün tersine ° 7.6'da olduğu.
%50 D- ve %50 L -amino asitlerin karışımına rasemat denir . Rasematlar, diğer şeylerin yanı sıra, amino asitlerin geleneksel teknik sentezlerinde ortaya çıkar. Optik olarak aktif değillerdir, yani polarize ışığın salınım düzlemini döndüremezler. Saf enantiyomerlerle karşılaştırıldığında, rasematlar bazen farklı fiziksel özelliklere sahiptir (örnek: erime noktası ), ancak sürekli olarak farklı fizyolojik özelliklere sahiptir.
Adlandırma kuralları ve adlandırma
Fischer projeksiyonu, amino asitler ve sakkaritler için hala tercih edilen projeksiyon sistemidir. Ek olarak, amino asitler için kiral moleküllerin mutlak konfigürasyonunu tanımlayan Cahn-Ingold-Prelog sözleşmesi (CIP sistemi) kullanılır. CIP sistemine göre, proteinojenik L- amino asitlerin çoğu ( S )-amino asitlerdir. Ayna görüntüleri, D- amino asitleri, neredeyse her zaman bir ( R )-konfigürasyonuna sahiptir. İstisnalar L - sistein , L - sistin ve L - selenosisteindir , çünkü CIP terminolojisine göre kükürt ve selenyum oksijenden daha yüksek önceliğe sahiptir . Bu üç L- amino asit ( R ) konfigürasyonundadır. Buna karşılık, karşılık gelen üç D- amino asit ( S ) konfigürasyonuna sahiptir.
Olarak , amino asit dizileri , D içinde amino asitler üç harfli kod olan bir öncesinde küçük sermaye D (küçük harf).
Heptapeptid dermorfin örneğini kullanma
H-Tyr-D-Ala-Phe-Gly-Tyr-Pro-Ser-NH2
Tek harfli kodda , D- amino asitler, küçük harf L- amino asitler ile sağlanır.
Dermorfin örneğinde:
YaFGYPS-NH2
Doğal oluşum ve keşif tarihi
D- amino asitler, doğada , proteinojenik amino asitlerin - nükleik asitlerle birlikte - yaşamın temel yapı taşlarını temsil ettiği izomerik L- amino asitlerden çok daha nadirdir . Karbonhidratlar durumunda iki tip enantiyomerin oluşumunda benzer bir asimetri vardır . Burada D -formu, örneğin D - glukoz , “doğal” konfigürasyondur. D- glukozun dünyadaki L- glukozdan 10 15 kat daha fazla olduğu tahmin edilmektedir . Amino asitler için hala güvenilir tahminler yoktur.
Uzun bir süre boyunca, evrim sırasında peptitlerin ve proteinlerin oluşumu için sadece L- amino asitlerin seçildiği varsayıldı . 1980'lerden beri, geliştirilmiş analitik yöntemler bu varsayımın gözden geçirilmesine yol açmıştır. D- amino asitler, her geçen gün daha fazla canlıda tespit edildi, bu nedenle başlangıçta varsayıldığından çok daha büyük bir dağılıma ve sıklığa sahipler. Daha yakın tarihli literatürde, D- amino asitler bu nedenle bitkilerin ve gıdaların ortak bir bileşeni olarak kabul edilmektedir. Ancak, insanlar da dahil olmak üzere daha yüksek canlılarda bile, D- amino asitler, bazıları hala büyük ölçüde anlaşılamayan önemli fizyolojik süreçlerde yer alır.
Dünyadaki yaşamın gelişimi, homokiraliteyi , yani amino asitlerin ve yaşamın diğer yapı taşlarının tek tip bir konfigürasyonunu varsayıyordu . Kendi kendini kopyalama , rasemik bir ortamda gerçekleşemez . Amino asitlerin iki izomerik formunun frekansındaki aşırı dengesizliğin birincil nedeni hakkında bir takım hipotezler vardır . D ve L konfigürasyonu arasında doğada ilk küçük dengesizliğin olduğu noktadan itibaren yaygın bir fikir birliği vardır . Bundan sonra, kiral amplifikasyon (bir kimyasal reaksiyonda daha önce biraz fazla olan enantiyomerik formda daha fazla bir artışa yol açan bir tür kendi kendini güçlendiren etki) bir enantiyomerik formun aşırı zenginleşmesini açıklamak için kullanılabilir. kuyu. Bununla birlikte, büyük olasılıkla, dünyadaki yaşamın başlangıcından çok önce amino asitlerde L konfigürasyonunun başlangıçta hafif bir fazlalığına yol açan ayna simetrisinin nasıl kırıldığı tamamen belirsizdir . Ayna simetrisindeki kırılmanın olası nedenleri, diğer şeylerin yanı sıra, β-çürüme ( Vester-Ulbricht hipotezi ) sırasında paritenin ihlali ve dünya dışı L- amino asit fazlalıkları ile “ ilkel çorbanın aşılanması ” dır. İkinci teori, örneğin Murchison göktaşında , proteinojenik olmayan amino asitler 2-amino-2,3-dimetilpentanoik asit ve izovalinin ilgili L enantiyomerinin bir fazlalığının tespit edilebildiği gerçeğiyle desteklenir . Murchison göktaşında L- izovalin fazlalığı yaklaşık yüzde 18,5 ve Orgueil göktaşında yaklaşık yüzde 15,2 idi. Bu fazlalık muhtemelen - deneysel olarak doğrulanmış - tercihen D- amino asitleri yok eden dairesel polarize UV radyasyonu tarafından oluşturulmuştur .
Rasemizasyon ile D- amino asitlerin oluşumu
Daha büyük miktarlarda D- amino asitler, L- amino asitlerden rasemizasyondan kaynaklanabilir . Bir amino asit rasematının oluşumu , yani %50 D- ve %50 L- amino asitleri içeren bir karışım , termodinamik olarak tercih edilir. Entalpi değişmeden kalır, ancak bir artışa yol açar daha yüksek “bozukluğun derecesi” entropi bu araçlar, serbest entalpi Δ sisteminin G azalır. Yaklaşık -1.6 kJ / mol için 25 °C'deki değer . Daha yüksek sıcaklıklar daha yüksek serbest entalpi salınımına yol açar, bu nedenle rasemizasyon önemli ölçüde hızlanır. Yarı-ömür içinde zaman olarak tanımlanmaktadır rasemizasyon, ee-değeri 100 ila% 50 düşer olmayan bağlıdır sıcaklığında değil, aynı zamanda, sadece pH değeri , bir amino asit, bir çözücü ya da nem ve varlığı bir katalizör . Sabit koşullar altında, rasemizasyon önceden hesaplanabilir veya tersine, incelenen örneğin yaşı rasemizasyon derecesinden çıkarılabilir. Amino asit tarihlemesi olarak bilinen bu süreç, fosil örneklerinin yanı sıra canlı organizmaların da yaşını belirlemek için kullanılabilir. Ölümle birlikte, etkilenen organizmalarda amino asitlerin rasemizasyonuna karşı çalışan tüm süreçler sona erer. Hayat entropiye karşı bir mücadeledir ve en geç ölümle birlikte rasemizasyonu engelleyen süreçler sona erer. Son derece düşük protein metabolizmasına sahip bazı dokularda , bu süreç doku oluşturulduktan sonra başlar. Bunun bir örneği olan kolajen içinde bir dentin diş veya gözün lensi . Dişlerdeki nispeten sabit sıcaklık ve pH değerleri, aspartik asidin rasemizasyon derecesi ile yaklaşık ± 4 yıl hassasiyetle canlı organizmanın yaşının belirlenmesini de sağlar. Prosedür, diğer şeylerin yanı sıra adli tıpta kullanılır . Bu yöntemin etkinliğine bir örnek, 1996 yılında İmparator Lothar von Supplinburg'un (1075-1137) kemikleri üzerinde yapılan çalışmalardır . Eşi Richenza ve gururlu Heinrich ile karşılaştırıldığında, Lothar'ın çok daha yüksek bir rasemizasyon derecesine sahip olduğu bulundu , bu da yaklaşık 9.000 yıllık bir yaşa karşılık geliyor. Öte yandan, iki karşılaştırma örneğinin rasemizasyon derecesi, yaklaşık 850 yıllık yaşlarına çok iyi karşılık geldi. L- aspartik asidin rasemizasyon derecesi her üç durumda da ölçüldü . Lothar'daki yüksek derecede rasemizasyon, ölümünün özel koşullarından kaynaklanmaktadır. O yakın öldü Breitenwang içinde Tirol'un yaptığı karargahından 700 km hakkında, Königslutter AM Elm . Uzun nakliyeden önce cesedini çürümekten korumak için, ceset "Alman geleneğine" ( mos teutonicus ) göre tedavi edildi. Lothar'ın cesedi kaynatıldı, etleri kemiklerinden ayrıldı ve kemikler Königslutter'a aktarıldı. Kaynamanın bir sonucu olarak, 859 yıl sonra ölçülen L- aspartik asit, karısının ve damadın normalde gömülü olan cesetlerinde olduğundan çok daha güçlü bir şekilde rasemize oldu . Rasemizasyon derecesi kullanılarak, pişirme süresi yaklaşık altı saat olarak belirlenebilir.
Yaklaşık 5300 yıllık cesedin saç Tisenjoch gelen adam daha iyi "olarak bilinen, Ötzi " nin% 37 hidroksiprolin olduğu içinde D yapılandırması. 3000 yaşındaki bir mumyada %31, Orta Çağ'dan (yaklaşık 1000 yıllık) saçlarda %19 ve taze saç örneklerinde %4.
Proteinlerdeki L- amino asitler, gıda hazırlanırken sıcaklık ve aşırı pH değerlerinin etkisi altında da raseleşebilir. Tek tek amino asitler farklı oranlarda raseze olur. Rasemizasyon hızı, ilgili amino asidin yan zincirine ve çevresindeki amino asitlere güçlü bir şekilde bağlıdır. Elektron çeken gruplar, rasemizasyonu kolaylaştıran α-C atomunun protonasyonunu kolaylaştırır. Bu, örneğin serin ve aspartik asit için geçerlidir. Ek olarak, sterik etkiler de rol oynar. Asparagin ve aspartik asit, peptit sekansı yakın çevresinde bir glisin içeriyorsa özellikle kolayca rasemize olur. Daha sonra, termodinamik olarak güçlü bir şekilde epimerizasyonu destekleyen bir döngüsel süksinimit oluşabilir. Düşük pH değerlerinde, örneğin altı molar hidroklorik asitte, aspartik asit en güçlü şekilde rasemize olur. Bu koşullar altında prolin ve glutamik asit çok daha yavaş rasemleşirken , izolösin , valin , serin ve treonin çok az rasemize olur. Buna karşılık serin, bir molar sodyum hidroksit çözeltisinde en hızlı şekilde rasemize olur, ardından aspartik asit, fenilalanin , glutamik asit ve valin gelir.


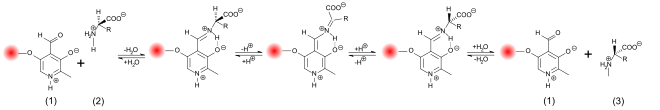
Baz ve asit katalizli rasemizasyon, birkaç saat içinde tam bir rasemizasyon elde etmek için oldukça şiddetli reaksiyon koşulları gerektirir. Buna karşılık, biyolojik sistemlerde enzim katalizli rasemizasyon çok daha hızlı ve çok hafif koşullar altında gerçekleşir - nötr pH aralığında ve oda veya vücut sıcaklığında. Rasemazlar, amino asidin a-C atomundaki proton gidermeyi katalize eder. Hidrojen atomu bu konumda yalnızca aşırı derecede zayıf asidiktir. Asitlik sabiti protonlanmış formu bir pKa değerine sahiptir, s ≈21 değeri ve izoelektrik noktasını daha da zayıf ≈29 ile. Çoğu rasemazda, protonun ayrılması piridoksal fosfat (PLP) tarafından çok daha kolay hale getirilir . Bu enzimlerin aktif merkezinde, PLP bir lizin kalıntısına bağlıdır . L- amino asidin amino grubu, PLP'nin aldehit grubuna bağlanır ve böylece bir Schiff bazı (aldimin) oluşturur. Bir de elektrofilik katalizör, PLP, çizer elektron amino asidin α-Cı atomundan ile aromatik halkaya daha kolay deprotone. Ek olarak, kalan anyon bir mezomer olarak stabilize edilir . Yeniden protonlama ve su ilavesi daha sonra Schiff bazının hidrolizi yoluyla bir reaksiyon ürünü olarak rasemize amino asidi serbest bırakır.
Aktif merkezinde iki sisteinin tiyol gruplarının protonasyonu katalize ettiği PLP'den bağımsız rasemazlar da vardır . İki bazlı bir mekanizmada, protonu giderilmiş bir tiolat (RS - ) başlangıçta α-C atomunun protonunu baz olarak alır. İkinci sisteinin tiyol grubu daha sonra reprotonasyondan sorumludur. Bu enzim katalizli rasemizasyon süreçleri , organizmalardaki D- amino asitlerin büyük çoğunluğunu üretir .
Peptit antibiyotikler ve doğal kaynaklı diğer peptit ilaçları

Çok sayıda peptit antibiyotik , D- amino asitlerden oluşur. Peptit antibiyotikler, prokaryotlar tarafından ribozomal olmayan peptit sentezi kullanılarak üretilen doğal ürünlerdir . Farmakolojik olarak çok önemli bir grubu penisilinler temel yapı taşı olarak içeren D - penisilamin , bir proteinojenik olmayan α-amino asidin. Polimiksinler (in Polimiksin B1 D -fenilalanin) ve aktinomisinler ( D -valin) da oluşur D -amino asitler. Bacillus subtilis türünün bakterileri tarafından oluşturulan basitrasin , diğer şeylerin yanı sıra D- aspartik asit, -glutamik asit, -ornitin ve -fenilalanin'den oluşur. Streptomyces fulvissimus tarafından üretilen valinomisin , D- valin ve Bacillus circulans'ın oluşturduğu circulin A ( D- leucine ) içerir. Ayrıca Fungisporin ( D- fenilalanin ve D- valin ), gramicidin ve tirosidin (hem D- fenilalanin ), malformin C ( D- lösin ve D- sistein), Mikobasilin ( D- aspartik asit ve D- glutamik asit) peptit antibiyotiklerdir. D- Amino asitler.
Tolypocladium inflatum gibi tübüler mantarlar tarafından salgılanan immünosupresan siklosporin , D -alanin içerir . Gelen izopenisilin N olan D dahil valin.
Sikloserin olup, kullanılan tedavi için tüberküloz ve nispeten basit bir kimyasal yapısı olan , tarafından üretilen Streptomisetler gibi Streptomyces garyphalus gelen D -serin,
D -amino asitler ve D -amino asitler içeren peptitler

Uzun bir süre, doğada sadece bir amino asit enantiyomerinin, yani L formunun baskın olduğu varsayılmıştır . 1960'lara kadar D- amino asitler "laboratuvar artefaktları" (sisteme bağlı hatalar) olarak kabul edildi ve "doğal olmayan izomerler" olarak sınıflandırıldı. "Doğal olmayan amino asitler" terimi bugün hala D- amino asitler için bulunabilir .

D- amino asit oksidazlar - substratsız enzimler mi?
1933'te Alman doktor, kimyager ve daha sonra Nobel fizyoloji veya tıp ödülü sahibi Hans Adolf Krebs , D - amino asit oksidaz enzimini keşfetti ve iki yıl sonra ayrıntılı olarak açıkladı. Krebs , saflaştırılmış taze domuz böbreği veya karaciğeri varlığında "doğal olarak oluşmayan" D- amino asitlerin, "doğal" L- izomerlerinden önemli ölçüde daha hızlı deamine edildiğini tespit eder . Hedeflenen inhibisyon yoluyla , örneğin 1-oktanol ile , pürede bulunan L- amino asit oksidazı deaktive edebildi ve böylece sadece D- amino asitlerin seçici olarak deaminasyonunu sağladı. Organlarda kullanılan kanser ya da bunların özütlerinden Sonuçlanan asit oksidazlar amino iki olduğunu edildi L - ve D , -Aminosäureoxidasen her seçici L - ya da D , bir şekilde amino asitler alt-tabaka vardır. Krebs, substrat olarak yalnızca "doğal olmayan maddelere" sahip bir enzim olmasına şaşırdı. Bununla birlikte, 1914'te Felix Ehrlich'in, 1884'te Edmund Oskar von Lippmann'ın ve 1923/24'te Sigmund Fraenkel'in doğada ara sıra D- amino asit oluşumunu tanımladığını belirtti . 1913 yılında E. Winterstein ve meslektaşları tarafından boletus mantarlarından ( Boletus edulis ) izole edilen D -alanin, bu ilk kayıtlardan biriydi.
Bitkilerde D amino asitler
D- amino asitler, olabilir , serbest formda ve peptit-bağlı formda hem de bitkilerde tespit edildi. Genellikle bitkilerde bulunan N - malonil - veya N - asetil - türevleri formundadırlar . Örneğin ayçiçeğinin ( Helianthus annuus ) kökündeki alaninin %40'ı D konfigürasyonundadır. D -alanin ve dipeptit D -Ala- D -Ala çeşitli otlarda bulunur; pirinçte de öyledir ( Oryza australiensis ). Pirinçteki serinin yaklaşık %10'u D enantiyomeri olarak mevcuttur. Bir serin rasemaz yardımıyla bitkinin kendisi tarafından üretilir. Bu enzime karşılık gelen gen Oryza sativa ssp. Japonica cv. 4. kromozom üzerinde Nipponbare D- amino asitler, gıda olarak kullanılan çok sayıda bitkide daha düşük konsantrasyonlarda bulunmuştur. Bunlara örneğin bezelye ( Pisum sativum ), sarımsak, çeşitli lahana türleri ve meyveler dahildir. Bitkilerdeki serbest ve peptit D- amino asitlerin işlevi hala büyük ölçüde belirsizdir.

Bakteriler ve D amino asitler
Serbest D mikrobiyal orijinin saptanmasından önce , bir dizi bileşik-amino asit D -amino asit tanımlanmıştı. Örnek için , benzilpenisilin , içinde oluşturulmuş olan kalıp kültürleri ve ilk olarak penisilin keşfedilen ile Alexander Fleming 1928, içeren D -penisilamin (= 3-merkapto- D- valin) , bir esas eleman olarak . Biyokimyacı Esmond E. Snell ile deneylerde 1943 fark kültürler arasında Streptococcus faecalis ve Lactobacillus casei bu piridoksin (B vitamini 6 ) , bu bakteri suşlarının büyümesi için gerekli olabilir tamamen yerini D bir besin maddesi olarak p-alaninin. Ayrıca D -alanin'in L -alanin'den önemli ölçüde daha güçlü olduğunu buldu . Peptidoglikanlarda büyük miktarlarda D -alanin tespit etmek mümkün olduğunda - bunlar bakterilerin hücre duvarına güçlerini veren biyopolimerlerdir - hücrelerin bu "doğal olmayan" amino aside ne için ihtiyaç duyduğu açıktı. Dahil edilmesi D , ve özellikle p-alaninin D , -glutamat ile peptidoglikanlara enzimatik parçalanmasını önler peptidazlar . İlginçtir ki, penisilin gibi β-laktam antibiyotiklerin saldırı noktası tam olarak D- amino asitlerden oluşan bu “koruyucu duvar” dır . Bu antibiyotikler , yalnızca bakterilerde bulunan ve özellikle D -alanin yoluyla peptidoglikanların çapraz bağlanmasını katalize eden D-alanin transpeptidaz enzimini inhibe eder . 1951 yılında, Irwin Clyde Gunsalus ve Willis A. Wood alanin rasemaz izole gelen Streptococcus faecalis , doğal rasemizasyonunun katalize eden bir enzim L izomer halinde p-alaninin D p-alaninin. Alr geni, alanin rasemaz için kodlar, tüm bakterilerde mevcut olduğu. Alanin rasemaz yardımıyla oluşan D - alanin , hemen hemen tüm bakterilerde peptidoglikanların sentezi için gereklidir. D -alanin ve D- glutamik aside ek olarak , bazı enterokok türleri de hücre duvarında D- serin içerir. D -serin oluşturan bir D -Ala- D -Ser dipeptid ile D de p-alaninin C-terminaline sorumludur, direnç için bu bakteri suşları antibiyotik glikopeptid örneğin vankomisin gibi.
Süngerlerdeki D amino asitler
Sözde polytheonamides tespit edilebilir içinde süngerler . Bunlar amino asitleri D ve L formları arasında değişen peptit toksinleridir . Görünüşe göre L- peptitleri olarak ribozomal olarak sentezlenirler ve daha sonra translasyon sonrası her ikinci amino asit epimerize edilir. Bu, bakterilerden türetilen genleri yatay gen transferi yoluyla süngerlere giren birkaç enzimin yardımıyla yapılır .
D amino asitler çok hücreli hücrelerde
Dankwart Ackermann ve M. Mohr 1937'de köpek balıklarının ( Acanthias vulgaris ) karaciğerinde D - ornitin tespit edebildiler . Krebs tarafından keşfedilen D- amino asit oksidaz sonraki yıllarda tüm memelilerde tespit edildi . H. Blaschko ve Joyce Hawkins onları ilk olarak 1951'de omurgasızlarda buldu . Bu enzimin çeşitli organizmalardaki işlevi belirsizliğini korudu. 1960'ların sonuna doğru, enzimin sindirim sisteminde büyük miktarlarda D- amino asit içeren gram-pozitif bakterilerin hücre duvarı bileşenlerini parçalamak için kullanıldığı tahmin ediliyordu . D- amino asit oksidazın sadece dışarıdan sağlanan (dış kaynaklı) D- amino asitleri parçalamaya hizmet ettiği teorisi 1990'ların başına kadar vardı.
Gelen hemolimf Wanzenart arasında Oncopeltus fasciatus bir 1950 Auclair ve Patton ilk kez çok hücreli D tespit alanin. Analitik yöntem olarak iki boyutlu kağıt kromatografisini kullandılar . Sonra elüsyon için, bunlar ile kurutuldu kromatogramları püskürtülür D -amino deamine asit oksidaz, sadece D kolayca edilebilir bir ketokarboksilik asite alanine tespit ile fenilhidrazin . D -alanin varlığının nedeninin mikrobiyal flora, gıda yoluyla alım ve yaşlanma yoluyla kendiliğinden rasemizasyon olduğundan şüphelenildi .
Biyosentezi ve D -serin liderliğindeki bir araştırma grubu tarafından 1965 yılında gösterilmiştir John J. Corrigan'ın de Tufts Üniversitesi Tıp Okulu'nda içinde Massachusetts . İpek böcekleri beslenen ile radyoaktif olarak etiketlenmiş D - glukoz hem üretilen L- ve D- serin. Daha sonra D- amino asitler diğer böceklerde ve memelilerde de bulundu .
1962 liderliğindeki bir İtalyan araştırma grubu izole Vittorio Erspamer Güney Amerika içinde kurbağa arasında fuscomaculatus Physalaemus taşikinin physalaemin . Bu polipeptit on iki amino asitten oluşur ve N-ucundan bakıldığında D- prolin ile başlar . Tek harfli kodda, sıra pEADPNKFYGLM-NH2. Mikrobiyolojik kökenli olmayan bir D- amino asit ile keşfedilen ilk doğal peptittir . Ama üç yıl sonra, örneğin, Amerikan biyokimyacı Alton Meister yazdığı yaptığı standart çalışmalarında aminoasitlerin Biyokimya o “şu anda oluşması için kesin bir kanıt yoktur D asitleri amino bitki ve hayvan proteinlerde” . İlk başta, Erspamer'in keşfi neredeyse hiç fark edilmedi. Aynı çalışma grubu zaman sadece 19 yıl sonra izole dermorphin içinde siğil gibi makro kurbağa ( Phyllomedusa sauvagii ), aynı zamanda Güney Amerika'ya özgü olan keşif kapsamı yavaş yavaş kabul edildiğini,. N-terminalinden bakıldığında, yedi amino asitten oluşan dermorfin, 2 konumunda bir D - alanin'e sahiptir . D alanin konfigürasyonu farmakolojik aktivitesi için gereklidir. Bağlanmadığını Dermorphin μ 1 reseptörü ve çok daha seçici ve kuvvetli vücudun kendi daha endorfin ( dinorfinler ve enkefalinler ) ve farmakolojik olarak yaygın bitki morfin . Keşif bazı paradigmalarla çelişiyordu, bu nedenle Erspamer, çalışma grubunun sonuçlarını yayınlayan bir dergi bulmakta önemli zorluklar yaşadı. Bu paradigmalardan biri, protein biyosentezinde , bir organizmanın DNA'sının yalnızca L konfigürasyonunda olan 20 kanonik amino asidi kodlamasıdır . D amino asitlerini kodlayan bir gen yoktur . Bu çelişki on yıl sonra çözüldü: Ökaryotik peptitlerde D- amino asitlerin oluşumundan epimerazlar tarafından katalize edilen stereoselektif bir post-translasyonel modifikasyon sorumludur . Bu, çeviriden sonra , özel, endojen bir enzimin etkisi altında, belirli bir L- amino asidin konfigürasyonunun değiştiği anlamına gelir.
D amino asitler memelilerde
D- amino asitlerin memelilerdeki biyolojik işlevi 1992 yılına kadar göz ardı edildi. Gaz ve yüksek performanslı sıvı kromatografisi (GC veya HPLC) gibi analitik ölçüm yöntemlerinin geliştirilmesinin bir sonucu olarak , 1980'lerden itibaren D- amino asitleri L- ayna görüntülerinden temiz bir şekilde ayırmak ve hatta onları tespit etmek mümkün hale geldi. en küçük miktarlar. 1992'de Atsushi Hashimoto ve meslektaşları , sıçanların beyninde nispeten büyük miktarlarda serbest D- serin buldular . Yaklaşık 0.27 µmol/g beyin kütlesi konsantrasyonu buldular. Bunlar tespit L -serin için içerik bir sonuçlandı 0.89 mmol / g, beyin kütlesi olarak D- to- L 0.23 oranında. Daha önce zaten biliniyordu D -serin harici (eksojen biçimde) olduğu temin güçlü bir seçici allosterik agonisti olarak , NMDA reseptörünün ( N -metil- D -aspartate). Daha sonra insanlar da dahil olmak üzere diğer memelilerin beyinlerinde de tespit edilen nispeten yüksek D- serin konsantrasyonlarının kaynağı başlangıçta belirsizliğini koruyordu. Rasemize L- serin'in gıdalardan alınması ve kan-beyin bariyerinden beyne taşınması gibi spekülasyonlar, 1999'da Herman Wolosker ve meslektaşları tarafından sıçanların beyninde serin rasemaz enziminin keşfiyle sona erdi . Serin rasemaz, serin rasemizasyonunu katalize eder. Amino asit rasemazları daha önce sadece bakterilerde ve bazı böceklerde biliniyordu. Enzim, nispeten yüksek D- serin konsantrasyonlarına sahip glial hücrelerde tespit edildi . Serin rasemazın saptanmasıyla, bu arkaik D- amino asit metabolizmasının memelilerde de korunduğu ve - daha sonra gösterileceği gibi - sinir iletiminde önemli bir işlevi yerine getirdiği gösterilebilir . Dogma olduğunu D- amino asitlerin özel fonksiyonlara sahip de ökaryotlarda terk edilmesi gerekiyordu. Bugün, D- Serine'nin öğrenme süreçleri ve hafıza fonksiyonu gibi merkezi sinir sisteminin sayısız süreçlerinde , aynı zamanda akıl hastalıkları , nöropatiler ve nörodejeneratif hastalıklarda önemli bir rol oynadığını biliyoruz .
Fizyolojik önemi
Serbest D amino asitler
1990'ların sonuna kadar, D amino asitlerinin omurgalılarda fizyolojik bir işlevi olmadığı varsayıldı . Memelilerin beyninde daha fazla miktarda D- serin ve D- aspartik asit saptanmasıyla, bu iki olağanüstü amino asidin işlevine ilişkin araştırmalar başladı. D- amino asitlerin fizyolojik etkileri üzerine yapılan araştırmalar , pek çok cevaplanmamış soru ile nispeten genç bir disiplindir.
D -Serin
Gliyal hücrelere ek olarak, D- Serin ayrıca sinir hücrelerinde (nöronlar) bulunur. Bu doğar L enzim serin katalitik etkisi altında-serin rasemazı ( AT bu hücrelerden elde edilen 5.1.1.18) olarak ifade olduğunu. Bozunma, D- amino asit oksidaz (EC 1.4.3.3)tarafındankatalizeedilir. Beyindeki D- serinkonsantrasyonu,bu iki birikme ve parçalanma süreci tarafından belirlenir. D- Serin, "doğal" ligandı amino asit glisin olan NMDA reseptörü üzerindebir ko-agonist görevi görür. Bu reseptör , bir dizi fizyolojik, aynı zamanda patolojik süreç için büyük önem taşımaktadır. D- serin, NMDA reseptörünün aktivitesini arttırır. Bu nedenle aynı zamanda bir ' nöromodülatör 'olarak da bilinir. D- serininartan yıkımına yol açan D- amino asit oksidazınaşırı ekspresyonu, sonuç olarak NMDA reseptöründeki aktiviteyi azaltır. Az aktif bir NMDA reseptörü esas olarak şizofreni ile ilişkilidir. Küçük miktarlarda NMDA reseptör antagonistleri bilesağlıklı deneklerde şizofreniye karşılık gelen bilişsel ve fizyolojik bozukluklargibi semptomları tetikleyebilir.
2002 yılında büyük bir uluslararası çalışma grubu, yeni keşfedilen G72 geninin ( DAOA geni, D-amino asit oksidaz aktivatörü ) şizofreni ile yakından ilişkili olduğunu buldu. Gen ürünü, bir G72 aktive D- asit oksidaz, amino azalır konsantrasyonunu D beyinde-serin. D- amino asit oksidaz aktivitesi ile şizofreni oluşumu arasında sadece zayıf bir ilişki buldular. Bununla birlikte, D- amino asit oksidaz ve G72 aktivatörünün kombinasyonu, karşılıklı olarak güçlü bir şekilde destekleyiciydi ( sinerjistik ). Yazarlar, sonuçta serbest D- serin konsantrasyonunun şizofrenide önemli bir rol oynadığı sonucuna varmışlardır . Diğer çalışmalar da D- amino asit oksidaz ve şizofreni arasında genetik bir bağlantı olduğunu göstermiştir . Şizofreni hastalarının kan serumu ve beyin omurilik sıvısındaki D- serin konsantrasyonunun bir grup sağlıklı test kişisine kıyasla önemli ölçüde azaldığını gösterebilen çalışma gruplarının sonuçları, bu bulgular doğrultusunda. Ek olarak, ölen şizofreni hastalarının beyinlerinde artan bir D- amino asit oksidaz ekspresyonu bulundu . Şizofreni hastalarının tedavisinde D- serin eklenmesi klinik deneylerde umut verici sonuçlar verdi. Bir meta-analiz 18 klinik çalışmalar şizofreni semptomlarında belirli bir azalma bulundu. Ancak iyileşme sadece orta düzeydeydi.
D- amino asit oksidaz ve D- amino asit oksidazın işlevi hakkındaki bilgiler , şizofreni tedavisi için potansiyel ilaçlar olan çeşitli D- amino asit oksidaz inhibitörlerinin geliştirilmesine yol açmıştır . D -amino asit oksidaz-inhibitörleri, bu etken madde ile herhangi bir ilaç yapılmamış olan ve böylece, çok erken bir gelişim aşamasında olan onaylanmış (2012 gibi).
Gliyal hücrelerde bu amino asidin aşırı konsantrasyonu ve buna bağlı eksitotoksisite , sinir sisteminin dejeneratif bir hastalığı olan amyotrofik lateral sklerozun olası bir nedeni olarak araştırılmaktadır.
D -aspartik asit
Serbest D- aspartik asit ilk kez 1986 yılında Amerikalı David S. Dunlop liderliğindeki bir çalışma grubu tarafından kemirgenlerin beyinlerinde ve insan kanında önemli miktarlarda tespit edildi . Bunlar bulunan en yüksek konsantrasyonlarda D -aspartate olarak serebral hemisfer nmol / g 164 yenidoğan sıçan . Bu, toplam aspartik asit miktarının %8.4'üne karşılık geldi. Bu konsantrasyon değeri, beyindeki birçok esansiyel L amino asidin değerini aşıyor . Beyne ek olarak, epifiz bezi , hipofiz bezi , adrenal bezler ve testislerde de nispeten yüksek miktarlarda D- aspartat tespit edilebilir. Benzer şekilde D -serin, D- aspartat enzimatik rasemizasyon organizmada oluşan L- bu durumda aspartat, D- aspartat rasemaz (EC 5.1.1.13) ve bozulma D-aspartat oksidaz ile gerçekleşir (EC 1.4 .3.1). D- aspartat konsantrasyonu , organizmanın yaşının artmasıyla büyük ölçüde azalır. D- aspartat rasemazın yüksek aktiviteleri, yüksek D- aspartik asit konsantrasyonlarının da tespit edilebildiği organlarda bulunur . Aktivitesi hipofiz bezinde en yüksektir. Aspartat rasemazın özellikle aspartat rasemazı tamamlayıcı ribonükleik asitte (RNA) fonksiyon kaybına neden olan retrovirüsler tarafından deaktivasyonu , D- aspartat konsantrasyonunda önemli bir azalmaya yol açar . Sonuç olarak, dendritik gelişim büyük ölçüde bozulur ve bu da hipokampusta nörogenezde belirgin hasara yol açar . Bu test sonuçlarına dayanarak, D- aspartat'ın nöronal gelişimin önemli bir düzenleyicisi olduğu varsayılmaktadır . D- aspartik asidin kesin fizyolojik etkileri hala büyük ölçüde belirsizdir. Araştırma alanı çok yeni. Örneğin, aspartat rasemaz 2010 yılında sadece memelilerde klonlanmıştır .
D- amino asit içeren peptitler
Bir organizma yaşlandıkça, özellikle aspartik asidin artan rasemizasyonu nedeniyle artan bir homokiralite kaybı vardır. Oksidatif stres ve UV radyasyonu bu kaybı hızlandırabilir. Rasemizasyon (aspartik asit aspartik asit rasemizasyonunun ingilizcesi ), bir süksinimid ara maddesinin oluşumu nedeniyle ilerler , bu sadece düşük bir aktivasyon enerjisinin özellikle kolay bir şekilde gerekli olmasını sağlayabilir. Proteinlerin bu enzimatik olmayan in vivo rasemizasyonu, öncelikle dentin içindeki kollajen veya göz merceğindeki kristalin gibi uzun ömürlü proteinleri etkileyen otonom bir yaşlanma sürecidir . Örneğin, göz merceğindeki aspartik asidin %0,14'ü hayatın her yılında rasemize olur. 30 yaşındaki bir kişide, göz merceğinin kristal yapısındaki aspartik asidin ortalama %4.2'si rasemize olur. Buna ek olarak enzimler veya haberci maddeler gibi diğer fonksiyonel proteinler de rasemizasyondan etkilenir. Peptidler içeren D amino asitler amino asitler de yer alır peptidler daha proteazlar ile enzimatik bozunmaya karşı önemli ölçüde daha kararlı olan L konfigürasyonu. Çoğu durumda, endojen bir proteinde rasemizasyon fizyolojik sorunlara yol açar. Proteinlerde rasemizasyon, fonksiyon kaybına ve organizmanın artık parçalayamayacağı çok çeşitli dokularda protein birikimine neden olur. Bazı klinik tablolarda rasemizasyonda artış gözlenebilir. Olarak ateroskleroz , amfizem , presbiyopi , katarakt ve dejenerasyonu kıkırdak ve beyin, aspartik asit rasemizasyon ilgili bir patolojik bir faktör olarak görülmektedir.
1988 yılında, rasemizasyon arttırılmış derecesi tespit edildi ilk kez bir β-amiloid senil plaklar ile ölmüş hastaların beyin Alzheimer hastalığı . Özellikle, D- aspartat ve D- serin tespit edilebilir. Daha sonra, 23. pozisyonda aspartik asidin rasemizasyonunun , Alzheimer hastalığının patogenezinde temel bir unsur olarak görülen hızlandırılmış peptit agregasyonuna yol açtığı anlaşıldı . 23. pozisyondaki rasemizasyonun aksine, 7. pozisyondaki rasemizasyon, azaltılmış peptit agregasyonuna yol açar. Alzheimer hastalığının gelişiminde önemli bir rol, muhtemelen protein yaşlanmasının neden olduğu ve dentindekine benzer şekilde ilerleyen β-amiloidin rasemizasyon süreçlerine atfedilir. Rasemizasyon peptit agregasyonunu hızlandırır ve proteazlar tarafından enzimatik bozunmayı daha zor hale getirir.
özellikler
Kimyasal ve fiziksel özellikler
Aşiral bir ortamda, D ve L amino asitleri, polarize ışığın dönüş yönü dışında, kimyasal ve fiziksel özelliklerinde tamamen aynıdır. Kiral bir ortamda önemli farklılıklar bulunabilir. Bu, özellikle doğası gereği kiral olan biyokimyasal süreçler için geçerlidir. Bunun pratik bir örneği , amino asit enantiyomerleri arasındaki tat farkıdır. L- amino asitlerden oluşan G-protein-bağlı tat reseptörleri , enantiyomerlerin farklı şekilde etkileştiği kiral bir ortamdır. Çoğu L amino asidin tadı " acı " olarak tanımlanırken , D amino asitlerininki genellikle "tatlı" olarak tanımlanır. Uç bir örnek D - triptofan'dır ; açık ara en tatlı amino asit, sakarozun tatlılığının 37 katına sahiptir . L -Triptofan ise L -Tirozin ile birlikte en acı amino asittir. Biyokimyasal süreçlerdeki diğer reseptörler veya enzimler ile etkileşimler buna uygun olarak farklı olabilir. Bu aynı zamanda özellikle bir veya daha fazla D- amino asit içeren peptitler ve proteinler için de geçerlidir .
Bir proteine bir D' nin dahil edilmesi veya bir L amino asidinin epimerizasyonu, stereokimyasal bir bakış açısından, tüm proteine tamamen yeni kimyasal ve fiziksel özellikler veren bir diastereomer oluşumuna neden olur . Biyokimyasal olarak, birincil yapıya yapılan bu müdahale, kendisinden türetilen peptidin ikincil , üçüncül ve dördüncül yapısı üzerinde önemli etkilere sahiptir . Biyokimyasal etki büyük ölçüde değişmiştir. İki aşırı durumda, ya tamamen kaybolabilir ( işlev kaybı ) ya da tamamen yeni olabilir, örneğin toksik etkiler sonucu ( işlev kazanımı ). Aksi takdirde L- amino asitlerden oluşan bir peptitte, D- amino asitler bir a-sarmalının oluşmasını engeller . Onlar 'sarmal kırma'. Yalnızca tamamen D veya L amino asitlerinden oluşan proteinler - eğer valin, glutamin , izolösin, alanin, metionin , lösin, glutamik asit veya triptofan gibi sarmal oluşturan amino asitler varsa - ayna görüntüsü olan sarmal bir yapı oluşturabilir. birbirinden. Karışık peptitlerle bu mümkün değildir.
toksikoloji
D- proteinojenik amino asitlerin izomerleri
Amino asitlerin - örneğin gıda takviyeleri şeklinde - yoğun oral alımının araştırıldığı çalışmalarda, serin ve aspartik asit hariç, "doğal" L konfigürasyonundaki tüm amino asitler, amino asitlerden daha fazla toksik etki göstermiştir . karşılık gelen D enantiyomeri. D amino asitler, çok çeşitli gıdaların doğal bir bileşenidir. Orada öncelikle “doğal” L- amino asitlerden rasemizasyon süreçleri yoluyla ortaya çıkarlar . Süt ürünleri gibi fermantasyon sürecinden geçen yiyecekler , artan miktarda D- amino asit içerir. Emmentaler içeren yaklaşık 0,7 g / kg arasında , D- amino asitler. Başlangıç ürünü olan inek sütünde bile , tüm amino asitlerin yaklaşık %1,5'i D konfigürasyonundadır.
Gıda yoluyla alınan D- amino asitlerin yaklaşık üçte birinin mikrobiyal kaynaklı olduğu tahmin edilmektedir . Besinlerde bulunan ve proteinlere bağlanan amino asitlerin organizma için kullanılabilmesi için proteinlerin sindirim sırasında kendi bileşenlerine, yani serbest amino asitlere parçalanması gerekir. Bir proteinde D amino asitleri varsa , proteinin proteolitik enzimlere erişimi önemli ölçüde kısıtlanabilir. İnsan sindirim sistemindeki enzimler, D - ve L - amino asitler arasındaki bağları kıramaz. Organizma tarafından bağırsak mukoza zarlarından emilebilmesi için gerekli olan bireysel amino asitlere, di- veya tripeptitlere parçalanma daha zor hale getirilir. Daha büyük peptit parçaları kullanılamaz ve feçesle atılır . Biyoyararlanım ve böylece de besin değeri, daha sonra büyük ölçüde azalır. D- amino asitleri içeren di- veya tripeptitler , serbest D- amino asitler gibi , peptit taşıyıcıları yoluyla emilebilir. Bu şekilde emilen D- amino asitlerin büyük bir kısmı tekrar böbrekler yoluyla atılır. Besin kaynağına ve ilgili D- amino aside bağlı olarak, D- amino asitlerin bazıları transaminasyon yoluyla L- amino asitlere dönüştürülür ve böylece protein biyosentezi için erişilebilir hale getirilir.
"Doğal olmayan" D- amino asitlerin bakteri hücre duvarına dahil edilmesi, onları proteazlara karşı dirençli hale getirir. Bu proteaz stabilitesi, insanlar için de büyük önem taşımaktadır, çünkü bir yetişkinin bağırsağında , sindirim için çok sayıda proteazla birlikte gerekli olan birkaç yüz gram bağırsak bakterisi vardır.
Çoğu D- gıda amino asitler hazırlanması sırasında oluşturulur. Yüksek sıcaklıklar ve kuvvetli asidik veya bazik koşullar (kısmi) rasemizasyona yol açar. Örneğin, yaklaşık% 14 aspartik asit olarak patates cipsi olup içinde D formu. Olarak kahve beyazlatıcıların bu% 17 ve Bacon şeritleri % 13. Serbest L amino asitleri, proteine bağlı olanlardan yaklaşık on kat daha yavaş rasemleşir. Rasemizasyon derecesi de büyük ölçüde amino asidin kendisine bağlıdır. Serin, hidroksil grubu nedeniyle özellikle kolayca raseleşme eğilimindedir . Jelatin üretiminde gerekli olan şiddetli koşullar - yüksek sıcaklıklarda asidik veya bazik sindirim - jelatinin kollajeninde özellikle aspartik asidin güçlü bir rasemizasyonuna yol açar. Oranı D toplam aspartat -aspartate ticari olarak temin edilebilir jelatin durumunda biraz üzerinde% 30 olabilir.

D amino asitleri, memeli organizması tarafından absorbe edildiklerinde, proteinlere, peptitlere veya metabolizmanın diğer (makro) moleküllerine dahil edilmezler. Vücut dokusunda değişmemiş formda bir birikim gözlenemez. Gıda ile veya kayıtlı infüzyon ile D -amino asitler, kısmen Hangi idrar atılır ve kısmen karaciğer ve böbrek enzim mevcut ile D "normal" metabolik ürünleri, deaminasyonu ile -Aminosäureoxidase , keto karboksilik asitler , oksitlenmiş . Enfüze edilmiş D- amino asitlerin toksisitesi ile ilgili olarak, D- amino asitlerin sağlığa zararlı olmadığını öne süren uzun yıllara dayanan deneyim, az ya da çok istem dışıdır . Bu ifadenin temeli, uzun yıllar boyunca yüksek doz amino asit rasematlarından oluşan parenteral beslenmeye ("yapay beslenme") iyi tolerans gösterilmesidir . Bu infüzyon çözeltileri, kaçınılmaz olarak rasemizasyona yol açan asit hidrolizi yoluyla proteinlerden yapılmıştır . Rasemik metionin ( DL -metionin) çok sayıda bir bileşeni olan besleme olarak hayvancılık endüstrisinde . Bu gösterilmiştir süt ineklerinin % 75'inden fazlasının olduğu D- metiyonin dönüşür L- metiyonin ve böylece biyolojik olarak temin edilebilir hale gelir.
Bu ampirik değerlerden bağımsız olarak, sıçan hayvan modelinde test sonuçları görülebilir. D- serin'in yüksek dozları (0.8 g/kg vücut ağırlığı aralığında) bu model organizmalarda akut tübüler nekroza yol açar ve bu D- serin uygulamasının kesilmesinden sonra tersine çevrilebilir. Böbrek fonksiyonu yaklaşık altı gün sonra tamamen yenilenir. Patolojik değişiklikler büyük ölçüde lizinoalaninin neden olduğu böbrek hasarına benzer . Bu yüksek konsantrasyonlarda D- serin'in neden böbrekler için toksik olduğu henüz kesin olarak açıklığa kavuşturulmamıştır. D -serin böbrek konsantrasyonunu azaltabilir glutation , korunması beklenen proksimal tübüler hücreler zararlı etkilerinden reaktif oksijen türlerinin (ROS). D- serinin D- amino asit oksidaz tarafından enzimatik parçalanması, yan ürün olarak hidrojen peroksit üretir , bu da hücre içi glutatyon arzını önemli ölçüde azaltır.
Aralık 1989'da Viyana'dan üç doktorun prestijli The Lancet dergisinde yayınlanan bir mesajı sansasyon yarattı . Mikrodalga fırında ısıttıkları sütte büyük miktarlarda D - prolin bulmuşlardı , bu görünüşe göre L- prolinin rasemizasyonuyla üretilmişti . Ayrıca, nörotoksik , nefro- ve hepatotoksik özellikleri D- proline bağladılar . Yayın, editörlere bir mektuptu ve hakemli bir yayın veya hatta kontrollü bir çalışma değildi. Yazarlar ayrıca bu rasemizasyonun elde edildiği test koşullarını da belirtmediler. Bundan bağımsız olarak rapor, mikrodalga cihazlarının kullanımına karşı dramatik formülasyonlar ve uyarılarla günlük ve haftalık basında yayınlandı . Ağustos 1990'da Federal Sağlık Ofisi gerçekleri açıklığa kavuşturdu, ancak bunlar kamuoyu üzerinde neredeyse hiç etkisi olmadı. Diğer bilim adamları, D- prolinin, yuttuktan sonra hızla parçalanan ve atılan günlük gıdaların normal bir bileşeni olduğunu belirtmişlerdir. Bununla birlikte, örneğin, Ağustos 1991'de “Mikrodalgalar sinirleri, karaciğeri ve böbrekleri zehirliyor” başlıklı bir dergi çıktı . Benzer iddialar bugün hala ilgili web sitelerinde bulunabilir.
Diğer çalışma gruplarının Viyanalı doktorların sonuçlarını yeniden üretme girişimleri başlangıçta başarısız oldu. Sütü ocakta 30 dakika kaynattıktan sonra bile D- prolin'de herhangi bir artış ölçülemedi. Test koşulları iki yıl sonra yayınlandı. Lancet-Letter'ın yazarları, sütü kapalı bir basınçlı kapta 10 dakika boyunca 174 ila 176 ° C'ye kadar ısıtmıştı - sütü ısıtmak için normal ev kaplarında ulaşılamayan bir sıcaklık aralığı. Lancet Letter'ın yazarları , D- prolin'in nörotoksisitesi üzerine yaptıkları açıklamada, 1978'deki civcivlere maddenin intraventriküler olarak , yani doğrudan bir serebral ventriküle enjekte edildiği deneylere atıfta bulundular . Sıçanlarda D- prolin'in toksisitesi üzerine sonraki çalışmalar , bileşiğin yüksek konsantrasyonlarda bile zararsız olduğunu göstermiştir.
Sütü mikrodalga cihazıyla ısıtırken - özellikle küçük çocuklar için - gerçek bir tehlike, şişe içeriğinin eşit olmayan şekilde ısıtılmasıdır ve bu da genellikle klinik olarak ilgili yanıklara yol açar.
D -proteinojenik olmayan amino asitlerin izomerleri
Proteinojenik olmayan amino asitlerin D izomerlerinin toksisitesi hakkında genel bir açıklama yapılamaz. Amino asitten amino aside çok bireyseldir. İlginç bir şekilde, D amino asitleri içeren bazı bileşikler , L izomerlerinden önemli ölçüde daha az toksiktir . Örnekler sikloserin ve penisilamindir . Örneğin, D- ve L- Penisilamin rasematının oral uygulaması için LD 50 değeri olan model organizma sıçan 365 mg/kg'dır. Ancak saf D- penisilamin için 1200 mg/kg'lık bir dozda bile toksisite belirtisi yoktur.
D peptitleri
D- peptitlerinin toksikolojik özellikleri hakkında genel ifadeler mümkün değildir. Proteazlara duyarlılık önemli ölçüde daha düşüktür ve immünojenik potansiyel, karşılık gelen L- peptidlerinkinden önemli ölçüde daha düşüktür .
analiz
Klasik prosedürler
D ve L enantiyomerlerinin içeriğinin hesaplanabileceği bir amino asit çözeltisinin optik dönme açısını belirlemek için bir polarimetre kullanılabilir . Ancak bunun için standartlaştırılmış koşullar (her şeyden önce konsantrasyon, sıcaklık ve çözücü) gereklidir. Ek olarak, yöntem sadece tek tek amino asitler için uygundur ve farklı amino asitlerin karışımları için uygun değildir. 1960'lardan 1980'lere kadar, türetilmiş amino asitleri ayırmak için iyon değişim kromatografisi de kullanıldı . Analiz edilecek amino asitler, ayırmadan önce L- amino asitler ile diastereomerik dipeptitlere dönüştürüldü. L - ve D - amino asit oksidaz gibi spesifik enzimlerle reaksiyona dayanan enzimatik yöntemler , amino asitlerin enantiyomerlerini belirlemeye yönelik klasik yöntemlere aittir. Kılcal elektroforez , diğer şeylerin yanı sıra , D- amino asitlerin analizi için kromatografik olmayan bir yöntem olarak da uygundur.
Kromatografik Süreç
Karmaşık amino asit karışımlarının bile kantitatif analizleri kromatografik yöntemler yardımıyla gerçekleştirilebilir . İlk olarak, karışımın tek tek bileşenleri sabit bir fazda ayrılır ve daha sonra bir detektör ile ölçülür. UV veya kütle spektrometreleri temel olarak dedektör olarak kullanılır ve gaz kromatografisinde alev iyonizasyon dedektörleri de kullanılır . Başlangıç karışımını sabit fazda ayırmak için iki farklı strateji kullanılır. En basit durumda, iki enantiyomer, iki izomerin farklı derecelerde etkileşime girdiği ve böylece farklı hızlarda elute olduğu bir kiral durağan faz üzerinde ayrılır . Ayırma, yalnızca enantiyomerler diastereomerlere dönüştürülürse, aşiral sabit fazda mümkündür. Gaz kromatografisi (GC) ve yüksek performanslı sıvı kromatografisi (HPLC), analitik yöntemler olarak kendilerini kanıtlamıştır . Enantiomerik saflık ve D- amino asitler de olabilir ile analiz , ince-tabaka kromatografisi .
Yalnızca özel kromatografik yöntemlerin geliştirilmesi , daha yüksek organizmaların organlarındaki D- amino asitlerin saptanmasını ve miktarını belirlemeyi mümkün kıldı .
gaz kromatografisi
Amino asitler bozunmadan buharlaştırılamaz. Gaz kromatografisinde ayırma ve analiz için bunların bozunmadan buharlaşabilen bileşiklere dönüştürülmesi gerekir. Bu amaçla, amino asitler genellikle iki aşamalı bir türevlendirme işlemine tabi tutulur. Örneğin, karboksi grubu, birinci aşamada etanol ile esterleştirilebilir ve ardından ikinci bir aşamada, amino grubu , trifloroasetil türevi (TFA) verecek şekilde trifloroasetik anhidrit ile dönüştürülebilir . N -TFA / O -etil işlemde oluşan bir amino asit türevi gaz kromatografisinde ayrışma olmadan buharlaştınldı ve bir kiral sabit faz üzerinde ayrılabilir. Kiral reaktiflerle türevlendirme, artan rasemizasyon riskini ve reaksiyon ortaklarının farklı reaksiyon kinetiğine sahip olmasını barındırır. Her ikisi de ölçüm sonucunu tahrif edebilir.
Yüksek performanslı sıvı kromatografisi
HPLC'de, gaz kromatografisiyle karşılaştırıldığında, kiral reaktifler ile türevlendirme ve örneğin RP-18 gibi kiral olmayan durağan fazların kullanımı hakim olmuştur. Örneğin, L - N- asetilsistein, türevlendirme için ftaldialdehit ile birlikte kullanılır . Ortaya çıkan diastereomer çifti (D - L ve L - L) farklı kimyasal ve fiziksel özelliklere sahiptir, bu da daha sonra geleneksel bir kolonda ayrılabileceği ve daha sonra tespit edilebileceği anlamına gelir.
sentez
Proteinojenik L- amino asitlerin çoğu fermantasyon ile üretilir. Bu mikrobiyolojik süreç D- amino asitler için uygun değildir. Artan D- amino asit talebini karşılamak için çeşitli üretim süreçleri geliştirilmiştir.
Strecker sentezi gibi klasik kimyasal sentezler her zaman amino asitlerin rasematlarını verir. Tek tek amino asitler bu karışımlardan zahmetli bir şekilde ayrılabilir ( rasemat çözünürlüğü ) veya L- amino asit, L - amino asit deaminazları vasıtasıyla enzimatik olarak nispeten kolay ayrılabilen ketokarboksilik aside dönüştürülür.
Sübstitüe edilmiş hidantoinler yoluyla D- amino asit sentezi daha zariftir . Hidantoinler, aldehitler, potasyum siyanür ve amonyum karbonattan Bucherer-Bergs reaksiyonu ( Bucherer-Bergs hidantoin sentezi olarak da adlandırılır) kullanılarak endüstriyel ölçekte üretilebilir . Oluşan amino asit, kullanılan aldehit seçimi ile belirlenir. Bu şekilde üretilen hidantoin edilebilir başka dönüştürülmüş içine D- amino sözde asit hydantoinase işlemi . Bu çoklu enzim prosesi Degussa (şimdi Evonik Degussa ) tarafından geliştirilmiştir ve üç reaksiyon adımından oluşur. İlk olarak, rasemik hidantuan türevi katalitik etkisi altında olan D - hydantoinase için N karbamoil- D amino asidi hidrolize. İkinci aşamada, N- karbamoil- D- amino asit, bir D- karbamoilaz yardımıyla enantiyomerik olarak saf amino aside daha da hidrolize edilir. Üçüncü adımda, hidantoin türevinin reaksiyona girmemiş enantiyomeri kimyasal veya enzimatik olarak rasemize edilir. Kimyasal rasemizasyon pH değerleri > 8'de gerçekleşir ve bir rasemaz eklenerek önemli ölçüde hızlandırılabilir. Diğer işlemlerle karşılaştırıldığında, hidantoinaz işlemi, rasemattan başlayarak %100'e varan teorik verimlerle enantiyomerik olarak saf amino asitler üretir.
kullanmak
D- amino asitlere yönelik dünya çapındaki talep , son birkaç yılda sürekli olarak artmıştır. 2017 için, yaklaşık 3,7 milyar ABD doları civarında bir pazar büyüklüğü öngörülmektedir.
D amino asitleri, örneğin tatlandırıcılar , böcek öldürücüler , kozmetikler ve hepsinden önemlisi, pazar gelişimi için büyük bir büyüme itici gücü olan çok sayıda peptit ilacında önemli yapı taşları olarak bulunur .
Penisilinlerin ( örneğin amoksisilin ) ve sefalosporinlerin ( örneğin sefaklor ) sentezi için her yıl birkaç bin ton D -4-hidroksifenilglisin ve D- fenilglisin gerekir .
D- amino asitler sadece bakterilerin hücre duvarlarındaki proteolitik bozulmaya karşı stabiliteyi arttırmakla kalmaz, aynı zamanda ilaçlara hedeflenen dahil edilmeleri, özellikle ağızdan alındığında stabilitelerini arttırır . Fonksiyonel grupların düzenindeki değişiklik ( konformasyon ) ayrıca moleküler yapıdaki moleküler yapının tasarımında daha fazla serbestlik derecesi sunar , bu da gelişmiş aktif bileşen özelliklerine yol açabilir. Üreme tıbbında kullanılan bir GnRH analoğu olan gonadorelin inhibitörü cetrorelix , örneğin beşi D konfigürasyonunda olan on amino asitten oluşur . Cetrorelix, bireysel amino asitlerden tamamen sentetik olarak oluşturulur. Diğer GnRH gibi analogları Leuprorelin , buserelin , degarelix , histerelin , nafarelin veya abareliks, aynı zamanda en az bir adet içeren D- amino asidi.
Tedavisi için ereksiyon bozukluğu kullanılan tadalafil daha iyi bir marka adı altında bilinen, Cialis olup, sentezinde D triptofan inşa edilmiştir. Antidiyabetik nateglinid grubundan glinid , yapılır D fenilalanin ve cis -4-izopropil-sikloheksan-karboksilik asit elde edildi. Fenilalanin, 1970'lerden beri bir antidepresan olarak kullanılmaktadır. Ucuz rasemat ilaç olarak kullanılır. Antidepresan ve analjezik etkinin önemli bir kısmı, L- fenilalanin ile karşılaştırıldığında, ruh halini iyileştiren L- tirozin, L- DOPA veya norepinefrine metabolize edilmeyen , ancak esas olarak enzim enkefalinazını inhibe eden D- fenilalanin'den gelir . Enkefalinazın bloke edilmesiyle kandaki enkefalinlerin kan seviyesi yükselir, bu da gözlenebilen ağrı kesici etkiye neden olur . Prosesin daha sonraki seyrinde, D- fenilalanin daha sonra esas olarak feniletilamine metabolize olur .
Böcek ilacı fluvalinate gruptan piretroıdler edilir onaylanan mücadele için başka şeylerin yanı sıra Varroa akarı , yapılır D- valin.
D -alanin, tatlandırıcı alitamın bir bileşenidir .
daha fazla okuma
- Ryuichi Konno, Hans Brückner, Antimo D'Aniello, George Fisher, Noriko Fujii, Hiroshi Homma: D-amino asitler: amino asitler ve protein araştırmalarında yeni bir sınır - pratik yöntemler ve protokoller. Nova Science Publishers, 2007, ISBN 1-60021-075-9 , 629 s.
- Loredano Pollegioni, Stefano Servi (Ed.): Doğal Olmayan Amino Asitler. Humana Press, 2011, ISBN 1-61779-330-2 , 409 s.
- Gyula Pályi, Luciano Caglioti, Claudia Zucchi (ed.): BioChirality'deki Gelişmeler. Elsevier, 1999, ISBN 0-08-043404-5 ( Google Kitap Arama'da sınırlı önizleme ).
İnternet linkleri
- Amino asitlerin D ve L formları
- Hanka Symmank: Bakteriyel peptit sentetazların fonksiyonel ve yapısal karakterizasyonu. Biyoloji, Kimya ve Eczacılık Bölümü, Berlin Hür Üniversitesi, Mayıs 2002
Bireysel kanıt
- ↑ a b Hans-Dieter Belitz , Werner Grosch , Peter Schieberle : Gıda kimyası ders kitabı. 5. baskı, Springer Verlag, 2001. ISBN 3-540-41096-1 ( Google kitap aramasında sınırlı önizleme ).
- ↑ a b c d Uwe Meierhenrich : Amino Asitler ve Yaşamın Asimetrisi: Oluşum Eyleminde Yakalandı. Springer, 2008, ISBN 3-540-76885-8 , s. 53–54 ( Google kitap aramasında sınırlı önizleme ).
- ↑ VS Lamzin, Z. Dauter, KS Wilson: Doğanın stereoizomerlerle nasıl başa çıktığı . İçinde: Yapısal biyolojide güncel görüş. Cilt 5, Sayı 6, Aralık 1995, sayfa 830-836, PMID 8749373 . (Gözden geçirmek).
- ↑ SA Fuchs, R. Berger ve diğerleri: Sağlık ve hastalıkta merkezi sinir sisteminde D-amino asitler. İçinde: Moleküler Genetik ve Metabolizma. Cilt 85, Sayı 3, Temmuz 2005, sayfa 168-180, doi: 10.1016 / j.ymgme.2005.03.003 . PMID 15979028 . (Gözden geçirmek).
- ↑ GF Joyce, GM Visser ve diğerleri: Poli (C) yönelimli oligo (G) sentezinde kiral seçim. İçinde: Doğa. Cilt 310, Sayı 5978, 1984 16-22 Ağustos, sayfa 602-604, PMID 6462250 .
- ↑ VV Avetisov, VI Goldanskii: Homokiralite ve stereospesifik aktivite: evrimsel yönler. İçinde: Biyo Sistemler. Cilt 25, Sayı 3, 1991, sayfa 141-149 , PMID 1912384 .
- ↑ N. Fujii, T. Saito: Homokiralite ve yaşam. İçinde: Kimyasal kayıt. Cilt 4, sayı 5, 2004, sayfa 267-278, doi: 10.1002 / tcr.20020 . PMID 15543607 . (Gözden geçirmek).
- ^ WA Bonner: Enantiyomer analizi ile bir kiralite kaynağı olarak beta bozunması için deneysel kanıt. İçinde: Hayatın Kökenleri. Cilt 14, Sayılar 1-4, 1984, sayfa 383-390, PMID 11536584 . (Gözden geçirmek).
- ^ WA Bonner: Parite ihlali ve biyomoleküler homokiralitenin evrimi. İçinde: Kiralite. Cilt 12, Sayı 3, Mart 2000, sayfa 114-126, doi : 10.1002 / (SICI) 1520-636X (2000) 12: 3 <114 :: AID-CHIR3> 3.0.CO; 2-N . PMID 10689289 . (Gözden geçirmek).
- ↑ JR Cronin, S. Pizzarello: Meteoritik amino asitlerde enantiyomerik aşırılıklar. İçinde: Bilim. Cilt 275, Sayı 5302, Şubat 1997, sayfa 951-955, PMID 9020072 .
- ↑ S. Pizzarello, M. Zolensky, KA Türk: Murchison göktaşında rasemik olmayan izovalin: kiral dağılım ve mineral birliği. İçinde: Geochimica ve Cosmochimica Acta. Cilt 67, Sayı 8, 2003, s. 1589-1595. doi: 10.1016 / S0016-7037 (02) 01283-8 .
- ↑ P. Schmitt-Kopplin , Z. Gabelica ve diğerleri .: Murchison meteoritindeki dünya dışı organik maddenin yüksek moleküler çeşitliliği, düşüşünden 40 yıl sonra ortaya çıktı. İçinde: PNAS. Cilt 107, Sayı 7, Şubat 2010, s. 2763-2768, doi: 10.1073 / pnas.0912157107 . PMID 20160129 . PMC 2840304 (ücretsiz tam metin).
- ↑ DP Glavin, JP Dworkin: CI ve CM göktaşı ana gövdelerinde sulu alterasyonla amino asit L- izovalin'in zenginleştirilmesi. İçinde: PNAS. Cilt 106, Sayı 14, Nisan 2009, s. 5487-5492, doi: 10.1073 / pnas.0811618106 . PMID 19289826 . PMC 2667035 (ücretsiz tam metin).
- ↑ PW Lucas, JH Hough ve diğerleri.: Yıldız oluşum bölgelerinde UV dairesel polarizasyonu: homokiralitenin kökeni? İçinde: Yaşamın kökenleri ve biyosferin evrimi. Cilt 35, Sayı 1, Şubat 2005, sayfa 29-60, PMID 15889649 .
- ↑ a b T. Carell : ( Sayfa artık mevcut değil , web arşivlerinde arama yapın: Lecture Stereochemistry. ) Bölüm 9: Racemizations LMU Münih, s. 150.
- ↑ Elizabeth R. Neswald: Kültürel bir savaş alanı olarak termodinamik: entropi ile büyülenme tarihi üzerine, 1850-1915. Rombach, 2003, ISBN 3-7930-9448-0 , s. 335.
- ↑ AS Kekulé: Oh, kimsenin bilmediği ne kadar iyi ... İçinde: Tagesspiegel. 12 Ocak 2011.
- ↑ T. Ogino, H. Ogino: Sürmemiş ve süpernümerer dişlerde aspartik asit rasemizasyonunun adli odontolojisine uygulanması. İçinde: Diş araştırmaları dergisi. Cilt 67, Sayı 10, Ekim 1988, sayfa 1319-1322, PMID 3170888 .
- ↑ T. Ogino, H. Ogino, B. Nagy: Adli odontolojiye aspartik asit rasemizasyonunun uygulanması: ölüm yaşının ölüm sonrası belirlenmesi. İçinde: Uluslararası Adli Bilimler. Cilt 29, Sayılar 3-4, 1985, sayfa 259-267, PMID 4076954 .
- ^ S. Ohtani, T. Yamamoto: D / L oranları ve yaşlar arasındaki korelasyon katsayısına özel referans ile aspartik asit rasemizasyon yöntemini kullanarak kronolojik yaş tahmini için strateji. İçinde: Adli Bilimler Dergisi. Cilt 50, Sayı 5, 2005, s. 1020-1027, PMID 16225206 . (Gözden geçirmek).
- ↑ JL Bada, B. Herrmann ve diğerleri: Kemikte amino asit rasemizasyonu ve Alman İmparatoru Lothar I'in kaynaması. İçinde: Uygulamalı Jeokimya. Cilt 4, Sayı 3, 1989, sayfa 325-327, doi: 10.1016/0883-2927 (89) 90036-X .
- ↑ a b Chris McManus: Sağ El, Sol El - Beyinlerde, Bedenlerde, Atomlarda ve Kültürlerde Asimetrinin Kökenleri. Harvard University Press, 2004, ISBN 0-674-01613-0 , s. 130 ( Google kitap aramasında sınırlı önizleme ).
- ↑ PM Masters, M. Friedman: Alkali ile işlenmiş gıda proteinlerinde amino asitlerin rasemizasyonu. İçinde: Tarım ve gıda kimyası dergisi. Cilt 27, Sayı 3, 1979 Mayıs-Haziran, sayfa 507-511, PMID 447924 .
- ↑ JL Bada: pH'ın bir fonksiyonu olarak amino asitlerin rasemizasyon kinetiği. İçinde: Amerikan Kimya Derneği Dergisi. Cilt 94, Sayı 4, Şubat 1972, sayfa 1371-1373, PMID 5060280 .
- ↑ H. Frank, W. Woiwode ve diğerleri.: Protein amino asitlerinin asidik katalizli rasemizasyon oranının belirlenmesi. İçinde: Liebigs Ann Kimya Numarası 3, 1981, s. 354-365. doi: 10.1002 / jlac.19819810303 .
- ↑ T. Geiger, S. Clarke: Peptitlerdeki asparaginil ve aspartil kalıntılarında deamidasyon, izomerizasyon ve rasemizasyon. Protein bozulmasına katkıda bulunan süksinimide bağlı reaksiyonlar. İçinde: Biyolojik Kimya Dergisi. Cilt 262, Sayı 2, Ocak 1987, s. 785-794, PMID 3805008 .
- ↑ a b c d e f g Thorsten Erbe: D-amino asitlerin oluşum mekanizmaları ve uygunluğu açısından kiral gaz kromatografisi-kütle spektrometrisi kullanılarak gıdalardaki amino asit izomerlerinin miktarının belirlenmesi. Tez, Justus Liebig Üniversitesi Giessen, 1999.
- ↑ A. Paquet, M. Ching-Yung: Yüksek performanslı sıvı kromatografisi kullanılarak alkali ile muamele edilmiş diyet proteinlerinde rasemizasyon değerlendirmesi. İçinde: Beslenme Araştırması. Cilt 9, Sayı 9, 1989, s. 1053-1065. doi: 10.1016 / S0271-5317 (89) 80066-1 .
- ↑ a b c M. Friedman: D-amino asitlerin kimyası, beslenmesi ve mikrobiyolojisi. İçinde: Tarım ve gıda kimyası dergisi. Cilt 47, Sayı 9, Eylül 1999, s. 3457-3479, PMID 10552672 . (Gözden geçirmek).
- ^ JP Richard, TL Amyes: Karbonda proton transferi. İçinde: Kimyasal biyolojide güncel görüş. Cilt 5, Sayı 6, Aralık 2001, sayfa 626-633, PMID 11738171 . (Gözden geçirmek).
- ↑ JP Richard, TL Amyes: Zwitteriyonik olmanın önemi üzerine: dekarboksilasyonun enzimatik katalizi ve katyonik karbonun protonsuzlaştırılması. İçinde: Biyoorganik Kimya. Cilt 32, Sayı 5, Ekim 2004, s. 354-366, doi: 10.1016 / j.bioorg.2004.05.002 . PMID 15381401 . (Gözden geçirmek).
- ↑ a b c d Daniel Björn Stein: Ribozomal olmayan peptit sentezinde epimerizasyon alanlarının substrat özgüllüğü ve işlevselliği. Doktora Tezi, Philipps University Marburg, 2006, s. 29.
- ↑ S. Glavas, ME Tanner: Aktif bölge glutamat rasemaz kalıntıları. İçinde: Biyokimya. Cilt 40, Sayı 21, Mayıs 2001, sayfa 6199-6204, PMID 11371180 .
- ↑ LM Fisher, JG Belasco ve diğerleri.: Prolin rasemazın enerjileri: katalitik adımlarda yer alan iki proton için geçiş durumu fraksiyonlama faktörleri. İçinde: Biyokimya. Cilt 25, Sayı 9, Mayıs 1986, sayfa 2543-2551, PMID 3521738 .
- ↑ Geoffrey Zubay: Yaşamın Kökenleri: Dünyada ve Kozmos'ta. Academic Press, 2000, ISBN 0-12-781910-X , s. 296 ( Google kitap aramasında sınırlı önizleme ).
- ↑ a b c J. J. Corrigan: Hayvanlarda D-amino asitler. İçinde: Bilim. Cilt 164, Sayı 3876, Nisan 1969, s. 142-149, PMID 5774186 .
- ↑ E. Abderhalden : Fermentforschung. Cilt 16-17, S. Hirzel, 1942, sayfa 301.
- ↑ HA kanseri: Hayvan vücudundaki amino asitlerin metabolizması üzerine çalışmalar. İçinde: Hoppe-Seyler'in fizyolojik kimya dergisi. Cilt 217, 1933, sayfa 191.
- ↑ a b H. A. Krebs: Amino asitlerin metabolizması: Amino asitlerin deaminasyonu. İçinde: Biyokimyasal dergi. Cilt 29, Sayı 7, Temmuz 1935, sayfa 1620-1644, PMID 16745832 . PMC 1266672 (serbest tam metin).
- ↑ a b H. Blaschko, J. Hawkins: Yumuşakça karaciğerinde D-Amino asit oksidaz. İçinde: Biyokimyasal dergi. Cilt 52, Sayı 2, Ekim 1952, sayfa 306-310, PMID 13018226 . PMC 1197987 (serbest tam metin).
- ↑ F. Ehrlich : Mayanın doğal olarak oluşan amino asitlerin rasemik bileşikleri üzerindeki asimetrik ve simetrik etkisi hakkında. In: Biochem Z. 63, 1914, s. 379-401.
- ↑ EO von Lippmann : Pancar melasında lösin ve tirozin oluşumu hakkında. İçinde: Ber Dtsch Chem Ges. Cilt 17, 1994, sayfa 2835-2840. doi: 10.1002 / cber.188401702243 .
- ^ S. Fraenkel, H. Gallia, A. Liebster, S. Rosen: Kazeinin uzun süreli triptik sindirim ürünleri hakkında. In: Biochem Z. Cilt 145, 1924, sayfa 225-241.
- ↑ E. Winterstein, C. Reuter ve R. Korolew: Bazı mantarların kimyasal bileşimi ve otoliz sırasında oluşan ürünler hakkında. İçinde: Landw Versuchsstat. LXXIX - LXX, 1913, sayfa 541-562.
- ↑ JH Birkinshaw, H. Raistrick, G. Smith: Mikroorganizmaların biyokimyasında araştırmalar: Fumaryl-dl-alanin (fumaromono-dl-alanide), Penicillium resticulosum sp.nov'un metabolik bir ürünü. İçinde: Biyokimyasal dergi. Cilt 36, Sayılar 10-12, Aralık 1942, sayfa 829-835, PMID 16747516 . PMC 1266878 (serbest tam metin).
- ↑ T. Robinson: Yüksek bitkilerde bulunan D-amino asitler. İçinde: Yaşam bilimleri. Cilt 19, Sayı 8, Ekim 1976, s. 1097-1102, PMID 792607 . (Gözden geçirmek).
- ↑ JL Frahn, RJ Illman: Phalaris tuberosa'da D-alanin ve D-alanil-D-alanin oluşumu. In: Phytochem Cilt 14, 1975, s. 1464-1465. doi: 10.1016 / S0031-9422 (00) 98674-6 .
- ↑ Y. Gogami, K. Ito ve diğerleri: Pirinçte D-serin oluşumu ve pirinç serin rasemazının karakterizasyonu. İçinde: Fitokimya. Cilt 70, Sayı 3, Şubat 2009, s. 380-387, doi: 10.1016 / j.phytochem.2009.01.003 . PMID 19249065 .
- ↑ T. Ogawa, M. Fukuda, K. Sasaoka: Bezelye fidelerinde N-malonil-D-alanin oluşumu. İçinde: Biochimica ve Biophysica Açta . Cilt 297, Sayı 1, Ocak 1973, sayfa 60-69, PMID 4144329 .
- ↑ H. Brückner, S. Haasmann, A. Friedrich: GC-MS ve HPLC kullanılarak insan idrarındaki D-amino asitlerin miktar tayini. İçinde: Amino Asitler. Cilt 6, 1994, sayfa 205-211. doi: 10.1007 / BF00805848 .
- ↑ EE Snell, BM Guirard: Bazı Laktik Asit Bakterileri Üzerindeki Etkilerinde Piridoksin, Alanin ve Glisinin Bazı Karşılıklı İlişkileri. İçinde: PNAS. Cilt 29, Sayı 2, 1943, sayfa 66-73, PMID 16588604 . PMC 1078561 (serbest tam metin).
- ↑ J. Olivard, EE Snell: B6 vitamini analoglarının büyüme ve enzimatik aktiviteleri. I. D-Alanin sentezi. İçinde: Biyolojik Kimya Dergisi. Cilt 213, Sayı 1, Mart 1955, s. 203-214, PMID 14353919 . PMC 1078561 (ücretsiz tam metin).
- ↑ EE Snell: B6 vitamini grubu: VII Bazı mikroorganizmalar için B6 vitamininin d (-) - alanin ve kazeinden tanımlanamayan bir faktör ile değiştirilmesi. İçinde: J Biol Chem. Cilt 158, 1945, sayfa 497-503.
- ↑ Albert Gossauer: Biyomoleküllerin yapısı ve reaktivitesi. John Wiley & Sons, 2003, ISBN 3-906390-29-2 , s. 347 ( Google kitap aramasında sınırlı önizleme ).
- ^ WA Wood, IC Gunsalus: D-Alanin oluşumu; Streptococcus faecalis'te bir rasemaz. İçinde: Biyolojik Kimya Dergisi. Cilt 190, Sayı 1, Mayıs 1951, sayfa 403-416, PMID 14841188 .
- ^ J. Ju, H. Misono, K. Ohnishi: Daha yüksek ekspresyon seviyesine sahip bakteriyel alanin rasemazlarının yönlendirilmiş evrimi. İçinde: Biyobilim ve biyomühendislik dergisi. Cilt 100, Sayı 3, Eylül 2005, sayfa 246-254, doi: 10.1263 / jbb.100.246 . PMID 16243272 .
- ↑ RJ Thompson, HG Bouwer ve diğerleri: Büyüme için D-alanin gerektiren bir Listeria monocytogenes suşunun patojenitesi ve immünojenisitesi. İçinde: Enfeksiyon ve Bağışıklık. Cilt 66, Sayı 8, Ağustos 1998, sayfa 3552-3561, PMID 9673233 . PMC 108386 (ücretsiz tam metin).
- ↑ D. Billot-Klein, L. Gutmann ve diğerleri.: Peptidoglikan öncülerinin modifikasyonu, düşük seviyeli vankomisine dirençli VANB tipi Enterococcus D366'nın ve doğal olarak glikopeptid dirençli Lactobacillus casei, Pediococcus pentosaceus, Leuconostoc türlerinin ortak bir özelliğidir. mesenteroides ve Enterococcus gallinarum. İçinde: Bakteriyoloji Dergisi. Cilt 176, Sayı 8, Nisan 1994, sayfa 2398-2405, PMID 8157610 . PMC 205365 (ücretsiz tam metin).
- ↑ PE Reynolds, HA Snaith ve diğerleri: Vankomisine dirençli Enterococcus gallinarum BM4174'te peptidoglikan öncüllerinin analizi. İçinde: Biyokimyasal dergi. Cilt 301, Temmuz 1994, sayfa 5-8, PMID 8037690 . PMC 1137133 (ücretsiz tam metin).
- ↑ CA Arias, M. Martín-Martinez ve diğerleri .: VanT'nin karakterizasyonu ve modellenmesi: vankomisine dirençli Enterococcus gallinarum BM4174'ten yeni, zara bağlı, serin rasemaz. İçinde: Moleküler mikrobiyoloji. Cilt 31, Sayı 6, Mart 1999, s. 1653-1664, PMID 10209740 .
- ↑ a b Norma Christine Stäbler: Corynebacterium glutamicum ile D-amino asitlerin oluşumuna yönelik araştırmalar. Tez, Heinrich Heine Üniversitesi Düsseldorf, 2010, s. 7.
- ↑ MF Freeman, C. Gurgui ve diğerleri: Metagenom Madenciliği, Politeonamidleri Posttranslasyonel Olarak Değiştirilmiş Ribozomal Peptitler Olarak Ortaya Çıkarıyor. İçinde: Bilim. [baskı öncesi elektronik yayın] Eylül 2012, doi: 10.1126 / science.1226121 . PMID 22983711 .
- ↑ T. Hamada, S. Matsunaga ve diğerleri: Deniz süngerinden elde edilen oldukça sitotoksik bir ribozomal olmayan polipeptit olan politeonamid B'nin çözelti yapısı. İçinde: Amerikan Kimya Derneği Dergisi. Cilt 132, sayı 37, Eylül 2010, s. 12941-12945, doi: 10.1021 / ja104616z . PMID 20795624 .
- ↑ D. Ackermann , M. Mohr: Köpekbalığının karaciğerinin azotlu bileşenleri hakkında (Acanthias vulgaris). In: Z Biol. Cilt 98, sayı 37, 1937, s. 26.
- ^ LR Lyle, JW Jutila: Mikropsuz farelerin böbreklerinde D-amino asit oksidaz indüksiyonu. İçinde: Bakteriyoloji Dergisi. Cilt 96, Sayı 3, Eylül 1968, sayfa 606-608, PMID 4389707 . PMC 252348 (ücretsiz tam metin).
- ↑ JL Auclair, RL Patton: Süt yosunu böceğinin hemolenfinde D-Alanin oluşumu üzerine, Oncopeltus fasciatus. İçinde: Revue canadienne de biologie. Cilt 9, Sayı 1, Nisan 1950, sayfa 3-8, PMID 15417891 .
- ↑ a b Gianluca Molla, Luciano Piubelli ve diğerleri: D-Amino Asitlerin Enzimatik Tespiti. İçinde: Loredano Pollegioni, Stefano Servi (Ed.): Doğal Olmayan Amino Asitler. Cilt 794, 2012, ISBN 978-1-61779-330-1 , s. 273-289. doi : 10.1007 / 978-1-61779-331-8_18 .
- ↑ NG Srinivasan, JJ Corrigan, A. Meister: İpekböceğinde D-Serin Biyosentezi, Bombyx mori. (PDF; 665 kB) İçinde: Biyolojik kimya Dergisi. Cilt 240, Şubat 1965, sayfa 796-800, PMID 14275137 .
- ↑ JJ Corrigan, NG Srinivasan: Böceklerde belirli D-amino asitlerin oluşumu. İçinde: Biyokimya. Cilt 5, Sayı 4, Nisan 1966, sayfa 1185-1190, PMID 5958195 .
- ↑ Y. Nagata, K. Yamamoto ve diğerleri: Farelerde serbest D-alanin, D-prolin ve D-serin varlığı. İçinde: Biochimica ve Biophysica Açta . Cilt 1115, Sayı 3, Ocak 1992, sayfa 208-211, PMID 1346751 .
- ↑ P. Melchiorri, L. Negri: Dermorfin peptit ailesi. İçinde: Genel farmakoloji. Cilt 27, Sayı 7, Ekim 1996, s. 1099-1107, PMID 8981054 . (Gözden geçirmek).
- ↑ A. Anastasi, V. Erspamer, JM Cei: Physalaemus fuscumaculatus derisinin ana aktif polipeptidi olan physalaemin'in izolasyonu ve amino asit dizisi. İçinde: Biyokimya ve biyofizik arşivleri. Cilt 108, Kasım 1964, s. 341-348, PMID 14240587 .
- ↑ Rebecca Jo Jackway: Avustralya Amfibilerinden Biyolojik Olarak Aktif Peptitler. Doktora Tezi, University of Adelaide, 2008, s. 165.
- ↑ kelimenin tam anlamıyla: Şu anda bitki ve hayvanların proteinlerinde D-amino asitlerin oluşumuna dair kesin bir kanıt yoktur. Alton Meister: Amino asitlerin biyokimyası Academic Press, 1965.
- ↑ M. Broccardo, V. Erspamer ve diğerleri: Amfibi derisinden yeni bir güçlü opioid peptit sınıfı olan dermorfinler hakkında farmakolojik veriler. In: İngiliz farmakoloji dergisi. Cilt 73, Sayı 3, Temmuz 1981, sayfa 625-631, PMID 7195758 . PMC 2071698 (ücretsiz tam metin).
- ^ V. Erspamer, P. Melchiorri ve diğerleri.: Deltorphins: delta opioid bağlanma bölgeleri için yüksek afinite ve seçiciliğe sahip, doğal olarak oluşan peptitlerin bir ailesi. İçinde: PNAS. Cilt 86, Sayı 13, Temmuz 1989, sayfa 5188-5192, PMID 2544892 . PMC 297583 (ücretsiz tam metin).
- ↑ M. Amiche, A. Delfour, P. Nicolas: Kurbağa derisinden opiod peptidleri. İçinde: Pierre Jollès (Ed.): Çok Hücreli Organizmaların Salgılanan Peptidlerinin Dizilerinde D-Amino Asitler. Springer, 1998, ISBN 3-7643-5814-9 , s. 57-72 ( Google kitap aramasında sınırlı önizleme ).
- ↑ LH Lazarus, M. Attila: Çirkin ve zehirli kurbağa, cildinde yine de değerli bir mücevher taşıyor. İçinde: Nörobiyolojide ilerleme. Cilt 41, Sayı 4, Ekim 1993, sayfa 473-507, PMID 8210414 . (Gözden geçirmek).
- ^ G. Kreil: Kurbağalardan ve yumuşakçalardan elde edilen bir D-amino asit içeren peptitler. İçinde: Biyolojik Kimya Dergisi. Cilt 269, Sayı 15, Nisan 1994, sayfa 10967-10970, PMID 8157620 . (Gözden geçirmek).
- ↑ SD Heck, WS Faraci ve diğerleri.: Translasyon sonrası amino asit epimerizasyonu: peptit zincirlerindeki amino asit kalıntılarının enzim katalizli izomerizasyonu. İçinde: PNAS. Cilt 93, Sayı 9, Nisan 1996, sayfa 4036-4039, PMID 8633012 . PMC 39482 (ücretsiz tam metin).
- ↑ R. Liardon, R. Jost: Güçlü mineral asitte serbest ve proteine bağlı amino asitlerin rasemizasyonu. In: Uluslararası peptit ve protein araştırmaları dergisi. Cilt 18, Sayı 5, Kasım 1981, s. 500-505, PMID 7341532 .
- ↑ H. Brückner, T. Westhauser, H. Gödel: o-ftaldialdehit ve N-izobütiril-L-sistein ile türevlendirme yoluyla D- ve L-amino asitlerin sıvı kromatografik tayini. Peptidik antibiyotiklerin, toksinlerin, ilaçların ve farmasötik olarak kullanılan amino asitlerin analizine ilişkin uygulamalar. İçinde: Kromatografi Dergisi. A. Cilt 711, Sayı 1, Eylül 1995, sayfa 201-215, PMID 7496491 .
- ↑ RH Buck, K. Krummen: Enantiyomerik amino asitlerin ve amino alkollerin o-ftaldialdehit ve çeşitli kiral merkaptanlarla türevlendirildikten sonra yüksek performanslı sıvı kromatografik tayini. Peptit hidrolizatlarına uygulama. İçinde: Kromatografi Dergisi. Cilt 387, Ocak 1987, sayfa 255-265, PMID 3558624 .
- ^ A. Hashimoto, T. Nishikawa ve diğerleri: Sıçan beyninde serbest D-serin varlığı. İçinde: FEBS mektupları. Cilt 296, Sayı 1, Ocak 1992, sayfa 33-36, PMID 1730289 .
- ↑ a b N.W. Kleckner, R. Dingledine: Xenopus oositlerinde eksprese edilen NMDA reseptörlerinin aktivasyonunda glisin gereksinimi. İçinde: Bilim. Cilt 241, Sayı 4867, Ağustos 1988, sayfa 835-837, PMID 2841759 .
- ↑ a b H. Wolosker, S. Blackshaw, SH Snyder: Serin rasemaz: glutamat-N-metil-D-aspartat sinir iletimini düzenlemek için D-serin sentezleyen bir glial enzim. İçinde: PNAS. Cilt 96, Sayı 23, Kasım 1999, sayfa 13409-13414, PMID 10557334 . PMC 23961 (ücretsiz tam metin).
- ↑ H. Wolosker, E. Dumin ve diğerleri: Beyindeki D-amino asitler: Nörotransmisyon ve nörodejenerasyonda D-serin. İçinde: FEBS dergisi. Cilt 275, Sayı 14, Temmuz 2008, s. 3514-3526, doi: 10.1111 / j.1742-4658.2008.06515.x . PMID 18564180 . (Gözden geçirmek).
- ↑ S. Sacchi, M. Bernasconi ve diğerleri.: pLG72, D-amino asit oksidaz ile etkileşimi yoluyla hücre içi D-serin seviyelerini modüle eder: şizofreni duyarlılığı üzerindeki etkisi. İçinde: Biyolojik Kimya Dergisi. Cilt 283, Sayı 32, 2008, sayfa 22244-22256, doi: 10.1074 / jbc.M709153200 . PMID 18544534 .
- ↑ HJ Ryu, JE Kim ve diğerleri: Deneysel temporal lob epilepsisinde D-serin ve serin rasemazın potansiyel rolleri. İçinde: Nörobilim araştırmaları dergisi. Cilt 88, sayı 11, 2010, s. 2469-2482, doi: 10.1002 / jnr . 22415 . PMID 20623543 .
- ^ SA Fuchs, R. Berger, TJ de Koning: D-serin: doğru mu yanlış izoform mu? İçinde: Beyin araştırmaları. Cilt 1401, Temmuz 2011, s. 104-117, doi: 10.1016 / j.brainres.2011.05.039 . PMID 21676380 . (Gözden geçirmek).
- ↑ Julia Scharlau: Adolesan kronik kannabinoid tedavisinin bir fare şizofreni modeli üzerindeki etkileri üzerine çalışmalar. (PDF; 827 kB) Doktora Tezi, Friedrich-Wilhelms-Universität Bonn, 2012, s. 16.
- ↑ E. Kartvelishvily, M. Shleper ve diğerleri.: Nöron türevli D-serin salınımı, N-metil-D-aspartat reseptörlerini aktive etmek için yeni bir yol sağlar. İçinde: Biyolojik Kimya Dergisi. Cilt 281, Sayı 20, Mayıs 2006, sayfa 14151-14162, doi: 10.1074 / jbc.M512927200 . PMID 16551623 .
- ↑ K. Miya, R. Inoue ve diğerleri: Serin rasemaz ağırlıklı olarak fare beynindeki nöronlarda lokalizedir. İçinde: Karşılaştırmalı Nöroloji Dergisi. Cilt 510, Sayı 6, Ekim 2008, s. 641-654, doi: 10.1002 / cne.21822 . PMID 18698599 .
- ↑ L. Pollegioni, S. Sacchi: Nöromodülatör D-serin metabolizması. İçinde: Hücresel ve moleküler yaşam bilimleri. Cilt 67, Sayı 14, Temmuz 2010, sayfa 2387-2404, doi: 10.1007 / s00018-010-0307-9 . PMID 20195697 . (Gözden geçirmek).
- ↑ JT Kantrowitz, DC Javitt: N-metil-d-aspartat (NMDA) reseptör işlev bozukluğu veya düzensizliği: şizofreniye giden yolda son ortak yol mu? In: Beyin araştırmaları bülteni. Cilt 83, sayı 3-4, Eylül 2010, s. 108–121, doi: 10.1016 / j.brainresbull.2010.04.006 . PMID 20417696 . PMC 2941541 (ücretsiz tam metin). (Gözden geçirmek).
- ↑ JT Coyle: Glutamat ve şizofreni: dopamin hipotezinin ötesinde. İçinde: Hücresel ve moleküler nörobiyoloji. Cilt 26, Sayılar 4-6, 2006 Temmuz-Ağustos, s. 365-384, doi: 10.1007 / s10571-006-9062-8 . PMID 16773445 . (Gözden geçirmek).
- ↑ I. Chumakov, M. Blumenfeld ve ark.: Şizofrenide yeni insan geni G72 ve D-amino asit oksidaz geni ile ilgili genetik ve fizyolojik veriler. İçinde: PNAS. Cilt 99, Sayı 21, Ekim 2002, sayfa 13675-13680, doi: 10.1073 / pnas.182412499 . PMID 12364586 . PMC 129739 (ücretsiz tam metin).
- ^ A. Corvin, KA McGhee ve diğerleri.: İrlandalı bir şizofreni örneğinde DAOA / G30 ve D-amino asit oksidaz lokuslarında ilişkilendirme ve epistasis için kanıt. İçinde: Amerikan tıbbi genetik dergisi. Cilt 144B, Sayı 7, Ekim 2007, sayfa 949-953, doi: 10.1002 / ajmg.b.30452 . PMID 17492767 .
- ↑ T. Ohnuma, N. Shibata ve diğerleri: Bir Japon şizofreni hasta popülasyonunda glisin ve serinle ilişkili genlerin ilişki analizi. İçinde: Nöro-psikofarmakoloji ve biyolojik psikiyatride ilerleme. Cilt 33, Sayı 3, Nisan 2009, s. 511-518, doi: 10.1016 / j.pnpbp.2009.02.004 . PMID 19223009 .
- ↑ K. Hashimoto, T. Fukushima ve diğerleri.: Şizofreni hastalarında azalan serum D-serin seviyeleri: şizofreninin N-metil-D-aspartat reseptör hipofonksiyonu hipotezini destekleyen kanıt. İçinde: Genel psikiyatri arşivleri. Cilt 60, Sayı 6, Haziran 2003, sayfa 572-576, doi: 10.1001 / archpsyc.60.6.572 . PMID 12796220 .
- ↑ I. Bendikov, C. Nadri u a. .: Şizofrenide D-serin metabolik parametrelerinin BOS ve ölüm sonrası beyin çalışması. İçinde: Şizofreni araştırması. Cilt 90, sayı 1-3, Şubat 2007, sayfa 41-51, doi: 10.1016 / j.schres.2006.10.010 . PMID 17156977 .
- ↑ K. Hashimoto, G. Engberg ve ark.: Daha önce ilaç kullanmamış şizofreni hastalarının beyin omurilik sıvısındaki D-serin/toplam serin oranı azaltıldı. İçinde: Nöro-psikofarmakoloji ve biyolojik psikiyatride ilerleme. Cilt 29, Sayı 5, Haziran 2005, s. 767-769, doi: 10.1016 / j.pnpbp.2005.04.023 . PMID 15939521 .
- ↑ L. Verrall, M. Walker ve diğerleri: insan beyninde d-Amino asit oksidaz ve serin rasemaz: şizofrenide normal dağılım ve değişmiş ifade. İçinde: Avrupa sinirbilim dergisi. Cilt 26, Sayı 6, Eylül 2007, s. 1657-1669, doi: 10.1111 / j.1460-9568.2007.05769.x . PMID 17880399 . PMC 2121142 (ücretsiz tam metin).
- ↑ L. Verrall, PW Burnet ve diğerleri: D-amino asit oksidazın nörobiyolojisi ve şizofrenideki rolü . İçinde: Moleküler psikiyatri. Cilt 15, Sayı 2, Şubat 2010, sayfa 122-137, doi: 10.1038 / mp.2009,99 . PMID 19786963 . PMC 2811712 (serbest tam metin). (Gözden geçirmek).
- ↑ R. Kapoor, KS Lim ve diğerleri.: Şizofreni ile NMDA-glisin bölgesi reseptör ligandı metabolik enzimleri, d-amino asit oksidaz (DAAO) ve kinurenin aminotransferaz-1 (KAT-1) arasındaki bağlantı için ön kanıtlar. İçinde: Beyin araştırmaları. Cilt 1106, sayı 1, Ağustos 2006, sayfa 205-210 , doi: 10.1016 / j.brainres.2006.05.082 . PMID 16828464 .
- ↑ C. Madeira, ME Freitas ve diğerleri: Şizofrenide artan beyin D-amino asit oksidaz (DAAO) aktivitesi. İçinde: Şizofreni araştırması. Cilt 101, sayı 1-3, Nisan 2008, s. 76-83, doi: 10.1016 / j.schres.2008.02.022 . PMID 18378121 .
- ^ JT Coyle, G. Tsai, DC Goff: Şizofrenide terapötik hedefler olarak iyonotropik glutamat reseptörleri. İçinde: Mevcut ilaç hedefleri. Cilt 1, Sayı 2, Nisan 2002, sayfa 183-189, PMID 12769626 . (Gözden geçirmek).
- ↑ G. Tsai, P. Yang ve diğerleri: Şizofreni tedavisi için antipsikotiklere eklenen D-serin. İçinde: Biyolojik psikiyatri. Cilt 44, Sayı 11, Aralık 1998, s. 1081-1089, PMID 9836012 .
- ^ HJ Tuominen, J. Tiihonen, K. Wahlbeck: Şizofreni için glutamaterjik ilaçlar. İçinde: Sistematik incelemelerin Cochrane veritabanı (çevrimiçi). Sayı 2, 2006, S. CD003730, doi: 10.1002 / 14651858.CD003730.pub2 . PMID 16625590 . (Gözden geçirmek).
- ↑ DV Ferraris, T. Tsukamoto: D-amino asit oksidaz inhibitörlerinin keşfindeki son gelişmeler ve şizofrenide terapötik yararları. İçinde: Mevcut farmasötik tasarım. Cilt 17, Sayı 2, 2011, sayfa 103-111, PMID 21361869 . (Gözden geçirmek).
- ↑ CA Strick, C. Li ve diğerleri: Kemirgen beyninde D-amino asit oksidazın inhibisyonu ile NMDA reseptör fonksiyonunun modülasyonu. İçinde: Nörofarmakoloji. Cilt 61, sayı 5-6, 2011 Ekim-Kasım, s. 1001-1015, doi: 10.1016 / j.neuropharm.2011.06.029 . PMID 21763704 .
- ↑ T. Sparey, P. Abeywickrema ve diğerleri: Yeni, güçlü D-amino asit oksidaz (DAO) inhibitörleri olarak kaynaşmış pirol karboksilik asitlerin keşfi. İçinde: Biyoorganik ve tıbbi kimya mektupları. Cilt 18, Sayı 11, Haziran 2008, s. 3386-3391, doi: 10.1016 / j.bmcl.2008.04.020 . PMID 18455394 .
- ↑ Berry JF, Ferraris DV, Duvall B, et al. : D-Amino Asit Oksidaz İnhibitörleri olarak 1-hidroksi-1H-benzo [d] imidazol-2 (3H)-onların sentezi ve SAR'ı . İçinde: ACS Med Chem Lett . 3, No. 10, 2012, s. 839-843. doi : 10.1021/ml300212a . PMID 23243487 .
- ↑ Sacchi S, Rosini E, Pollegioni L, Molla G: Şizofreni Tedavisi için Yeni Bir İlaç Sınıfı Olarak D-Amino Asit Oksidaz İnhibitörleri . İçinde: Curr. Eczacılık Des. . 2012. PMID 23116391 .
- ↑ Paul P, de Belleroche J: Amyotrofik lateral skleroz patogenezinde D-amino asitlerin rolü: bir derleme . İçinde: Amino Asitler . 43, No. 5, 2012, s. 1823-1831. doi : 10.1007/s00726-012-1385-9 . PMID 22890612 .
- ↑ Sasabe J, Chiba T, Yamada M, et al. : D-serin, amyotrofik lateral sklerozda glutamat toksisitesinin önemli bir belirleyicisidir . İçinde: EMBO J. . 26, No. 18, 2007, sayfa 4149-4159. doi : 10.1038 / sj.emboj.7601840 . PMID 17762863 . PMC 2230675 (serbest tam metin).
- ↑ DS Dunlop ve diğerleri Neidle A.: Kemirgenlerde ve insanda serbest D-aspartik asidin varlığı. İçinde: Biyokimyasal ve biyofiziksel araştırma iletişimi. Cilt 141, Sayı 1, Kasım 1986, sayfa 27-32, PMID 3801000 .
- ↑ H. Wolosker, A. D'Aniello, SH Snyder: Nöronal ve endokrin dokularda D-aspartat yerleşimi: ontojeni, biyosentez ve salınım. İçinde: Sinirbilim. Cilt 100, Sayı 1, 2000, sayfa 183-189, PMID 10996468 .
- ↑ M. Katane, H. Homma: D-aspartat oksidaz: memelilerde serbest D-aspartat üzerinde etkili olan tek katabolik enzim. İçinde: Kimya ve biyoçeşitlilik. Cilt 7, sayı 6, Haziran 2010, s. 1435-1449, doi: 10.1002 / cbdv.200900250 . PMID 20564562 . (Gözden geçirmek).
- ↑ a b H. Ohide, Y. Miyoshi ve diğerleri.: Memelilerde D-Amino asit metabolizması: biyosentez, bozunma ve metabolik çalışmanın analitik yönleri. İçinde: Kromatografi Dergisi. B Cilt 879, sayı 29, Kasım 2011, s. 3162-3168, doi: 10.1016 / j.jchromb.2011.06.028 . PMID 21757409 . (Gözden geçirmek).
- ↑ a b P. M. Kim, X. Duan ve diğerleri: Nöronal D-aspartat üreten aspartat rasemaz, yetişkin nörogenezini düzenler. İçinde: PNAS. Cilt 107, Sayı 7, Şubat 2010, sayfa 3175-3179, doi: 10.1073 / pnas.0914706107 . PMID 20133766 . PMC 2840285 (ücretsiz tam metin).
- ↑ Y. Mori, K. Aki ve diğerleri.: UV B-ışınlaması, deri keratininde aspartil kalıntılarının rasemizasyonunu ve izomerizasyonunu ve N?-Karboksimetil lizin (CML) üretimini arttırır. İçinde: Kromatografi Dergisi B. Cilt 879, sayı 29, Kasım 2011, sayfa 3303-3309, doi: 10.1016 / j.jchromb.2011.05.010 . PMID 21636332 .
- ↑ N. Fujii, Y. Kaji ve diğerleri .: Yaşlanma sırasında çeşitli dokulardan proteinlerdeki amino asitlerin homokiralitesinin çökmesi. İçinde: Kimya ve biyoçeşitlilik. Cilt 7, sayı 6, Haziran 2010, s. 1389-1397, doi: 10.1002 / cbdv.200900337 . PMID 20564552 . (Gözden geçirmek).
- ↑ N. Fujii: Yaşlı dokularda D-amino asit. İçinde: Biyolojik ve farmasötik bülten. Cilt 28, Sayı 9, Eylül 2005, s. 1585-1589, PMID 16141520 . (Gözden geçirmek).
- ↑ Graham C. Barrett, Donald Trevor Elmore: Amino Asitler ve Peptitler. Cambridge University Press, 1998, ISBN 0-521-46292-4 , s. 15-16 ( Google Kitap Arama'da sınırlı önizleme ).
- ^ S. Ritz-Timme , MJ Collins: İnsan proteinlerinde aspartik asidin rasemizasyonu. İçinde: Yaşlanma araştırması incelemeleri. Cilt 1, Sayı 1, Şubat 2002, sayfa 43-59, PMID 12039448 . (Gözden geçirmek).
- ↑ H. Mori, K. Ishii ve diğerleri.: Rasemizasyon: Alzheimer hastalığının nöropatogenezindeki biyolojik önemi. İçinde: Tohoku deneysel tıp dergisi. Cilt 174, Sayı 3, Kasım 1994, sayfa 251-262, PMID 7761990 .
- ^ R. Shapira, GE Austin, SS Mirra: Alzheimer hastalığında nöritik plak amiloidi yüksek oranda rasemizedir. İçinde: Nörokimya Dergisi. Cilt 50, Sayı 1, Ocak 1988, sayfa 69-74, PMID 3121789 .
- ↑ AE Raw, JD Lowenson u a. .: Beta-amiloid çekirdek proteininin peptit omurgasındaki yapısal değişiklikler, Alzheimer hastalığında birikmesini ve stabilitesini açıklayabilir. İçinde: Biyolojik Kimya Dergisi. Cilt 268, Sayı 5, Şubat 1993, s. 3072-3083, PMID 8428986 .
- ↑ a b T. Tomiyama, S. Asano ve diğerleri: Asp23 kalıntısının rasemizasyonu, Alzheimer amiloid beta protein analoglarının agregasyon özelliklerini etkiler. İçinde: Biyolojik Kimya Dergisi. Cilt 269, Sayı 14, Nisan 1994, s. 10205-10208, PMID 8144598 .
- ^ Patrick R. Hof, Charles V. Mobbs: Yaşlanmanın Sinirbilimi El Kitabı. Academic Press, 2009, ISBN 0-12-374898-4 , s. 41 ( Google Kitap Arama'da sınırlı önizleme ).
- ↑ ML Moro, MJ Collins, E. Cappellini: Alzheimer hastalığı ve beyinde amiloid beta-peptid birikimi: bir 'yaşlanma' meselesi mi? İçinde: Biyokimya Derneği işlemleri. Cilt 38, Sayı 2, Nisan 2010, sayfa 539-544, doi: 10.1042 / BST0380539 . PMID 20298218 . (Gözden geçirmek).
- ^ Günter Westphal, Gerhard Gerber, Bodo Lipke: Proteinler - Besleyici ve fonksiyonel özellikler. Springer, 2003 ISBN 3-540-00232-4 , s. 125 ( Google kitap aramasında sınırlı önizleme ).
- ^ Gerhard G. Habermehl , Peter E. Hammann ve diğerleri: Doğal madde kimyası. 3. baskı, Springer, 2008, ISBN 3-540-73732-4 , s. 252 ( Google kitap aramada sınırlı önizleme ).
- ↑ NJ Benevenga, RD Steele: Aşırı amino asit tüketiminin olumsuz etkileri. İçinde: Beslenmenin yıllık gözden geçirilmesi. Cilt 4, 1984, sayfa 157-181, doi: 10.1146 / annurev.nu.04.070184.001105 . PMID 6235826 . (Gözden geçirmek).
- ↑ J. Zagon, L.-I. Dehne, K.-W. Bögl: Organizmalarda ve gıdalarda D-Amino asitler. İçinde: Nutr Res. Cilt 14, 1994, sayfa 445-463.
- ↑ Werner Baltes , Reinhard Matissek : Lebensmittelchemie 7. basım, Springer, 2011, ISBN 3-642-16538-9 , s. 164 ( Google kitap aramasında sınırlı önizleme ).
- ↑ W. Leuchtenberger, K. Huthmacher, K. Drauz: Amino asitlerin ve türevlerinin biyoteknolojik üretimi: mevcut durum ve beklentiler. İçinde: Uygulamalı Mikrobiyoloji ve Biyoteknoloji . Cilt 69, Sayı 1, Kasım 2005, sayfa 1-8, doi: 10.1007 / s00253-005-0155-y . PMID 16195792 . (Gözden geçirmek).
- ^ FH Leibach, V. Ganapathy: Bağırsakta ve böbrekte peptit taşıyıcıları. İçinde: Beslenmenin yıllık gözden geçirilmesi. Cilt 16, 1996, sayfa 99-119, doi: 10.1146 / annurev.nu.16.070196.000531 . PMID 8839921 . (Gözden geçirmek).
- ↑ a b c M. Friedman: D-amino asitlerin kökeni, mikrobiyolojisi, beslenmesi ve farmakolojisi. İçinde: Kimya ve biyoçeşitlilik. Cilt 7, sayı 6, 2010, sayfa 1491-1530, doi: 10.1002 / cbdv.200900225 . PMID 20564567 . (Gözden geçirmek).
- ^ W. Heine, K. Wutzke, U. Drescher: 15N-izleyici tekniği ile ölçülen bebeklerde D-amino asit kullanımı. İçinde: Klinik beslenme. Cilt 2, Sayı 1, Nisan 1983, sayfa 31-35, PMID 16829405 .
- ↑ M. Friedman, R. Liardon: Alkali ile muamele edilmiş soya fasulyesi proteinlerinde amino asit kalıntılarının rasemizasyon kinetiği. In: J Agric Food Chem Cilt 33, 1985, sayfa 666-672.
- ^ JC Crawhall, DF Elliott: Serinin rasemizasyonu üzerine bir not. İçinde: Biyokimyasal dergi. Cilt 48, Sayı 2, Şubat 1951, sayfa 237-238, PMID 14820833 . PMC 1275510 (ücretsiz tam metin).
- ^ M. Lüpke, H. Brückner: Jelatin üretimi ve işlenmesi sırasında amino asit epimerizasyonunun gaz kromatografik değerlendirmesi. İçinde: Gıda araştırma ve araştırma dergisi A. Cilt 206, sayı 5, 1998, s. 323–328. doi: 10.1007 / s002170050266 .
- ↑ Nutrition Report 1996. Alman Beslenme Derneği , 1996, ISBN 3-921606-33-0 , S. 149th
- ^ A b c Johannes Friedrich Diehl : Gıdalarda kimya. John Wiley & Sons, 2012, ISBN 3-527-66084-4 , s. 95 ( Google kitap aramasında sınırlı önizleme ).
- ↑ H. Lapierre, G. Holtrop ve diğerleri: D-metionin süt ineği için biyolojik olarak kullanılabilir mi? İçinde: Süt bilimi dergisi. Cilt 95, sayı 1, Ocak 2012, s. 353-362, doi: 10.3168 / jds.2011-4553 . PMID 22192214 .
- ^ WH Fishman, C. Artom: Serin yaralanma. İçinde: J Biol Kimya Cilt 145, 1942, s. 345-346.
- ^ RP Morehead, C. Artom, WH Fishman: Serinin nefrotoksik etkisi. İçinde: Bildiriler. Amerikan Klinik Araştırmalar Federasyonu. Cilt 2, 1945, sayfa 81, PMID 20275626 .
- ↑ FA Carone, CE Ganote: D-serin nefrotoksisitesi. Akut tübüler nekrozda proteinüri, glukozüri ve aminoasidürinin doğası. İçinde: Patoloji Arşivleri. Cilt 99, Sayı 12, Aralık 1975, sayfa 658-662, PMID 1203037 .
- ↑ RE Williams, EA Lock: D-serin kaynaklı nefrotoksisite: tirozin metabolizması ile olası etkileşim. İçinde: Toksikoloji. Cilt 201, sayı 1-3, Eylül 2004, sayfa 231-238, doi: 10.1016 / j.tox.2004.05.001 . PMID 15297036 .
- ↑ DR Peterson, FA Carone: d-serin kaynaklı akut tübüler nekrozu takiben renal rejenerasyon. İçinde: Anatomik kayıt. Cilt 193, Sayı 3, Mart 1979, s. 383-388, doi: 10.1002 / ar.1091930305 . PMID 426302 .
- ↑ CE Ganote, DR Peterson, FA Carone: D-serin kaynaklı nefrotoksisitenin doğası. İçinde: Amerikan patoloji dergisi. Cilt 77, Sayı 2, Kasım 1974, sayfa 269-282, PMID 4447130 . PMC 1910915 (serbest tam metin).
- ↑ MS Pilone, L. Pollegioni: Endüstriyel bir biyokatalizör olarak D-amino asit oksidaz. İçinde: Biyokataliz ve Biyotransformasyon. Cilt 20, Sayı 3, 2002, sayfa 145-159. doi: 10.1080 / 10242420290020679 .
- ↑ AW Krug, K. Völker ve diğerleri: D-serin nefrotoksik ve alfa-aminoizobütirik asit neden koruyucudur? ( İnternet Arşivinde 16 Ocak 2016 tarihli orijinalin hatırası ) Bilgi: Arşiv bağlantısı otomatik olarak eklendi ve henüz kontrol edilmedi. Lütfen orijinal ve arşiv bağlantısını talimatlara göre kontrol edin ve ardından bu uyarıyı kaldırın. İçinde: Amerikan Fizyoloji Dergisi - Böbrek fizyolojisi. Cilt 293, sayı 1, 2007, s. F382-F390, doi: 10.1152 / ajprenal.00441.2006 . PMID 17429029 .
- ↑ G. Lubec, C. Wolf, B. Bartosch: Aminoasit izomerizasyonu ve mikrodalgaya maruz kalma. İçinde: Lancet. Cilt 334, Sayı 8676, Aralık 1989, sayfa 1392-1393, PMID 2574327 .
- ^ Karl S. Kruszelnicki: Mikrodalgalar yiyeceklere zarar verir. İçinde: ABC abcscience. 23 Mart 2006
- ^ W. Segal: Sütün mikrodalgada ısıtılması. İçinde: Lancet. Cilt 335, Sayı 8687, Şubat 1990, sayfa 470, PMID 1968186 .
- ↑ Mikrodalga ile ışınlanan suyun bitkiler üzerindeki etkisi. Erişim tarihi: 24 Ağustos 2012.
- ↑ Tehlikeli mikrodalgalar. 24 Ekim 2008, erişim tarihi 28 Eylül 2012.
- ↑ P. Fritz, LI Dehne, J. Zagon, KW Bögl: Mikrodalga alanında amino asit izomerizasyonu sorusu üzerine: Standart çözeltilerle bir model deneyinin sonuçları. İçinde: Beslenme Bilimi Dergisi. Cilt 31, Sayı 3, 1992, sayfa 219-224.
- ↑ LI Dehne, P. Fritz: Mikrodalga ısıtma ile amino asitlerin izomerizasyonu? İçinde: Federal Sağlık Gazetesi. Cilt 35, 1992, sayfa 463-464.
- ↑ P. Sieber, P. Eberhardt, PU Gallmann: Ev tipi mikrodalga fırınlarda sütün ısıl işlemi. In: Int Süt Ürünleri Dergisi. Cilt 6, 1996, sayfa 231-246, doi: 10.1016/0958-6946 (95) 00009-7 .
- ↑ J. Zagon, L. Dehne, K.-W. Bögl: Gıdadaki amino asitlerin izomerizasyonu. Bölüm I: Organizmalarda ve Gıdalarda Amino Asit İzomerizasyonunun Mekanizmaları ve Dağılımı. İçinde: Beslenme incelemesi. Cilt 38, 1991, s. 275-278 ve 324-328.
- ↑ A. Cherkin, JL Davis, MW Garman: D-Proline: civcivde öldürücü konvülsan aktivitenin stereospesifikliği ve sodyum klorür bağımlılığı. İçinde: Farmakoloji, biyokimya ve davranış. Cilt 8, Sayı 5, Mayıs 1978, sayfa 623-625, PMID 674269 .
- ^ A. Schieber, H. Brückner ve diğerleri.: Gaz kromatografisi ile seçilen iyon izleme kütle spektrometrisi ile sıçandaki D-amino asit seviyelerinin değerlendirilmesi: oral olarak beslenen D-prolin ve D-aspartik asidin subakut toksisitesine dair kanıt yok. İçinde: Kromatografi Dergisi. Cilt 691, Sayı 1, Mart 1997, sayfa 1-12, PMID 9140753 .
- ^ SN Ali, G. O'Toole, M. Tyler: Süt şişesi yanıyor. İçinde: Yanık Bakımı ve Rehabilitasyon Dergisi. Cilt 25, Sayı 5, 2004, sayfa 461-462, PMID 15353942 .
- ^ IA Jaffe, K. Altman, P. Merryman: Penisilamin'in insanda antipiridoksin etkisi. İçinde: Klinik Araştırma Dergisi. Cilt 43, Ekim 1964, sayfa 1869-1873, doi: 10.1172 / JCI105060 . PMID 14236210 . PMC 289631 (ücretsiz tam metin).
- ↑ TN Schumacher, LM Mayr ve diğerleri: D-peptid ligandlarının ayna görüntüsü faj gösterimi yoluyla tanımlanması. İçinde: Bilim. Cilt 271, Sayı 5257, Mart 1996, s. 1854-1857, PMID 8596952 .
- ↑ Katja Wiesehan: Alzheimer amiloid-β-peptidi (Aβ) için spesifik bir ligandın tanımlanması ve karakterizasyonu. (PDF; 11.1 MB) Doktora Tezi, Bayreuth Üniversitesi, 2003, s. 21.
- ↑ JM Manning, S. Moore: LD ve LL dipeptitleri olarak iyon değişim kromatografisiyle D- ve L-amino asitlerin belirlenmesi. İçinde: Biyolojik Kimya Dergisi. Cilt 243, Sayı 21, Kasım 1968, sayfa 5591-5597, PMID 5699053 .
- ↑ K. Soda: 3, metil-2-benzotiazolon hidrazon hidroklorür ile D-amino asitlerin ve D-amino asit oksidaz aktivitesinin mikro tayini. İçinde: Analitik biyokimya. Cilt 25, Sayı 1, Ekim 1968, sayfa 228-235, PMID 4387536 .
- ↑ doi: 10.1002 / ardp.19863190515 .
- ↑ DL Kirschner, TK Green: Biyolojik matrislerde D-amino asitlerin ayrılması ve hassas tespiti. İçinde: Ayrılık bilimi dergisi. Cilt 32, Sayı 13, Temmuz 2009, sayfa 2305-2318, doi: 10.1002 / jssc.200900101 . PMID 19569111 . (Gözden geçirmek).
- ↑ K. Hamase, A. Morikawa ve diğerleri: Küçük miktarlarda D-amino asitlerin analizi ve memelilerde fizyolojik fonksiyonlarının incelenmesi. İçinde: Analitik bilimler. Cilt 25, Sayı 8, Ağustos 2009, s. 961-968, PMID 19667471 . (Gözden geçirmek).
- ↑ Clarissa Dorothee Marzini: Alfa-amino asitlerin kantitatif enantiyomer analizinin sınırları. (PDF; 1.7 MB) Tez, Eberhard-Karls-Universität Tübingen, 2007, s. 20–21.
- ↑ N. Nimura, T. Kinoshita: Amino asit enantiyomerlerinin sıvı kromatografik optik çözünürlüğü için kiral türevlendirme reaktifi olarak O-Phthaldialdehit N-asetil-L-sistein ve geleneksel amino asit analizine uygulamadır. İçinde: Kromatografi Dergisi A. Cilt 352, 1986, sayfa 169-177. doi: 10.1016 / S0021-9673 (01) 83377-X .
- ↑ Birgit Geueke: Rhodococcus opacus ve Arthrobacter protophormiae'den yeni amino asit oksidazlar: Biyokimyasal karakterizasyon, klonlama ve ekspresyon üzerine araştırmalar. (PDF; 9.6 MB) Tez, Heinrich Heine Üniversitesi Düsseldorf, 2002, s.
- ↑ E. Takahashi, M. Furui ve diğerleri.: Ardışık kimyasal rasemizasyon ve mikrobiyal asimetrik bozunma ile L-lizinden D-lizin üretimi. İçinde: Uygulamalı Mikrobiyoloji ve Biyoteknoloji . Cilt 47, Sayı 4, Nisan 1997, sayfa 347-351, PMID 9163947 .
- ↑ K. Isobe, H. Tamauchi ve diğerleri: Rhodococcus sp.'den L-Amino Asit Oksidaz Kullanılarak Çok Çeşitli D-Amino Asitlerin Üretimi için Basit Bir Enzimatik Yöntem. AIU Z-35-1. İçinde: Enzim araştırması. Cilt 2010, 2010, sayfa 567210, doi: 10.4061 / 2010/567210 . PMID 21048866 . PMC 2962901 (ücretsiz tam metin).
- ↑ Kerstin Ragnitz: Arthrobacter aurescens DSM 3747'den hidantoinaz ve LN karbamoylazın immobilizasyonu ve stabilizasyonu. (PDF; 997 kB) Dissertation, University of Stuttgart, 2000, s. 4.
- ↑ Global Industry Analysts, Inc. Tarafından Yapılan Yeni Bir Rapora Göre Küresel D-Amino Asit Pazarı 2017'ye Kadar 3,7 Milyar Dolara Ulaşacak. Adres : prweb.com, 25 Ağustos 2011.
- ↑ S. Martínez-Rodríguez, AI Martínez-Gómez ve diğerleri: D-amino asitlerin doğal oluşumu ve endüstriyel uygulamaları: genel bir bakış. İçinde: Kimya ve biyoçeşitlilik. Cilt 7, sayı 6, Haziran 2010, s. 1531-1548, doi: 10.1002 / cbdv.200900245 . PMID 20564568 . (Gözden geçirmek).
- ↑ a b Markus Werner: Arthrobacter crystallopoietes DSM 20117'den D-karbamoylazın klonlanması. Tez, Stuttgart Üniversitesi, 2001.
- ↑ B. Kutscher, M. Bernd: Yeni LHRH antagonistleri arayışında kimya ve moleküler biyoloji. İçinde: Angew Kimya Cilt 109, sayı 20, 1997, sayfa 2240-2254, doi: 10.1002 / ange.19971092005 .
- ↑ T. Beckers, M. Bernd ve diğerleri: GnRH reseptörünün lineer ve siklize peptit antagonistlerinin yapı-fonksiyon çalışmaları. İçinde: Biyokimyasal ve biyofiziksel araştırma iletişimi. Cilt 289, Sayı 3, Aralık 2001, sayfa 653-663, doi: 10.1006 / bbrc.2001.5939 . PMID 11726197 .
- ↑ Alaa A.-M. Abdel-Aziz, Yousif A. Asiri ve diğerleri: Tadalafil. ( Memento ait orijinal halinde 24 Aralık 2012 tarihinden itibaren Internet Archive ) Bilgi: arşiv bağlantısı otomatik olarak sokulmuş ve henüz kontrol edilmedi. Lütfen orijinal ve arşiv bağlantısını talimatlara göre kontrol edin ve ardından bu uyarıyı kaldırın. (PDF; 4.4 MB) İçinde: Harry G. Brittain (Ed.): İlaç Maddeleri, Yardımcı Maddeler ve İlgili Metodolojinin Profilleri. Academic Press, 2011, ISBN 0-12-387702-4 , s. 287–329 ( Google Kitap Arama'da sınırlı önizleme ).
- ↑ E. Fischer, B. Heller ve diğerleri: Fenilalanin ile depresyon tedavisi. Ön not. İçinde: ilaç araştırması. Cilt 25, Sayı 1, Ocak 1975, sayfa 132, PMID 1173765 .
- ↑ S. Ehrenpreis: Farmakolojik ajanlar olarak D-fenilalanin ve diğer enkefalinaz inhibitörleri: bazı önemli terapötik uygulamalar için çıkarımlar. İçinde: Madde ve alkol eylemleri / kötüye kullanımı. Cilt 3, Sayı 4, 1982, sayfa 231-239, PMID 6301083 .
- ↑ Mitchell Bebel Stargrove, Jonathan Treasure, Dwight L. McKee: Bitki, Besin ve İlaç Etkileşimleri. Elsevier Health Sciences, 2008, ISBN 0-323-02964-7 , s. 682 ( Google kitap aramasında sınırlı önizleme ).
- ^ Fenilalaninler. Maryland Üniversitesi Tıp Merkezi, 21 Eylül 2012'de erişildi.
- ^ DL Williams: Avrupa bal arısına veterinerlik yaklaşımı (Apis mellifera) In: Veterinary Journal. Cilt 160, sayı 1, Temmuz 2000, sayfa 61-73 , doi: 10.1053 / tvjl.2000.0474 . PMID 10950136 . (Gözden geçirmek).