Amonyum karbonat
| Yapısal formül | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
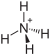 
| ||||||||||
| Genel | ||||||||||
| Soyadı | Amonyum karbonat | |||||||||
| diğer isimler | ||||||||||
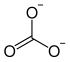
| Moleküler formül | CH 8 N 2 O 3 | |||||||||
| Kısa açıklama |
amonyak benzeri bir kokuya sahip higroskopik renksiz katı madde |
|||||||||
| Harici tanımlayıcılar / veritabanları | ||||||||||
| ||||||||||
| özellikleri | ||||||||||
| Molar kütle | ||||||||||
| Fiziksel durum |
sıkıca |
|||||||||
| yoğunluk |
1,13 g · cm -3 (25 ° C'de ) |
|||||||||
| Erime noktası |
58 ° C'den ayrışma |
|||||||||
| Buhar basıncı |
69 saat Pa (20 ° C) |
|||||||||
| çözünürlük |
suda iyi ( 20 ° C'de 320 g l −1 ) |
|||||||||
| güvenlik talimatları | ||||||||||
| ||||||||||
| Toksikolojik veriler | ||||||||||
| Termodinamik özellikler | ||||||||||
| ΔH f 0 |
−942 kJ mol −1 |
|||||||||
| Mümkün olduğunca ve geleneksel olarak, SI birimleri kullanılır. Aksi belirtilmedikçe, verilen veriler standart koşullar için geçerlidir . | ||||||||||
Amonyum karbonat , (NH 4 ) 2 CO 3 · H 2 O, suda çözünür, renksiz, kübik kristaller oluşturur. 58 ° C'den tamamen amonyak , karbondioksit ve suya dönüşür .
özellikleri
Tuz, hafif amonyak kokan renksiz bir toz oluşturur. 1.6 g · cm −3 (20 ° C'de) yoğunluğa sahiptir . Sulu çözelti içinde zayıf bazik reaksiyona girer , amonyak NH 3 , amonyum iyonları NH 4 + , karbonat iyonları CO 3 2− , hidrojen karbonat iyonları HCO 3 - ve karbondioksit CO 2 arasında bir denge kurulur . % 10 sulu çözeltinin pH'ı 9.4'tür.
Tuzlu su ile reaksiyona girer hidrojen karbonat oluşturmak üzere hidroksit iyonları . Sulu bir amonyum karbonat çözeltisi bu nedenle sadece nötr ve zayıf bazik bir ortamda stabildir - karbondioksit gazı asidik çözeltilerde kaçar ve konsantre alkali çözeltilerde amonyak gazı.
Amonyum karbonat havada ayrışır; sıcak olduğunda reaksiyon şiddetli olur.
Çıkarma ve sunum
Amonyum karbonat, karbon dioksitin sulu çözelti içinde amonyak ile reaksiyona sokulmasıyla hazırlanabilir.
Kalsiyum karbonatın amonyum sülfat ile birlikte ısıtılmasıyla bir başka sunum olasılığı ortaya çıkar .
İkinci yöntemle, istenen amonyum karbonata ek olarak, amonyum hidrojen karbonat ve amonyum karbamat da süblimleşirken , kalsiyum sülfat katı halde kalır .
kullanım
Amonyum karbonat, heterosikllerin sentezinde ve fotoğrafçılarda katkı maddesi olarak kullanılır . Ayrıca boyamada leke, leke çıkarma ajanı ve söndürme cihazlarında karbondioksit geliştirici olarak kullanılır.
Aynı zamanda bir yetiştirme maddesi olarak da kullanılır ( geyik boynuzu tuzunun bir bileşeni olarak ). In AB bunun edilir onaylı bir şekilde gıda katkı numarası E 503i .
Ayrıca daha önce baş dönmesi ve bayılma nöbetlerini uyarmak için kokulu bir tuz olarak burnun altına tutulmuştu.
Amonyum karbonat, genellikle kullanılan inorganik kimya için niteliksel analizi için çökeltmek alkali toprak metal katyonlar ve baryum , stronsiyum ve kalsiyum bir grup olarak içinde katyon ayırma işlemi , bilinmeyen bir örnek ayırmak için ve bunları tespit etmek yardımıyla algılama reaksiyonları.
Ayrıca katalizörler, köpükler, saç bakım maddeleri ve kazein renkleri ve yapıştırıcılarının üretiminde de kullanılır.
Bireysel kanıt
- ↑ ilgili kayıt E 503: Amonyum karbonat , Haziran 27, 2020 tarihinde erişilen gıda katkı maddeleri, Avrupa veritabanında depolanır.
- ↑ üzerinde giriş amonyum karbonat içinde bir Cosing veritabanı AB Komisyonu, 28 Aralık 2020 tarihinde erişti.
- ↑ a b c d Merck'ten amonyum karbonat veri sayfası (PDF), 19 Ocak 2011'de erişildi.
- ^ Carl L. Yaws: Kimyasalların ve Hidrokarbonların Termofiziksel Özellikleri . William Andrew, 2014, ISBN 978-0-323-29060-9 , s. 265 ( Google Kitap Arama’da sınırlı önizleme ).
- ↑ Amonyum karbonat girişi . İçinde: Römpp Çevrimiçi . Georg Thieme Verlag, 28 Aralık 2014'te erişildi.
- ↑ bir b c d e üzerine kayıt amonyum karbonat içinde bir GESTIS madde veritabanı IFA , 6 Şubat 2021 tarihinde erişilebilir. (JavaScript gerekli)
- ↑ PAETEC Formula Collection Edition 2003, s.116.


![{\ mathrm {\ \! \ {\ Biggr]} _ {2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/574adab1409cb81da6c38bb738ad111e61bbb2d9)
![{\ mathrm {\ \! \ {\ Biggr]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c9fd9553a0b623f5f669641be907d9186e35b739)


