hemoglobin
| Hemoglobin α alt birimi | ||
|---|---|---|

| ||
| Hemoglobin 1 yetişkin 2 α-zincirler (kırmızı) ve 4 2 β-zinciri (mavi) oluşan hema her biri grupları (yeşil), bağlanabilen bir O 2 molekülü (örnek göre PDB 1GZX ) | ||
|
Mevcut yapısal veriler : UniProt girişi | ||
| Kütle / uzunluk birincil yapısı | alt birim başına 16 kDa ; α zinciri 141, β zinciri 146 amino asit | |
| kofaktör | hamam | |
| tanımlayıcı | ||
| Gen adı (lar) | HbA1 , HbA2 | |
| Harici kimlikler | ||
| oluşum | ||
| homoloji ailesi | Beta-2 globin | |
| ana takson | Omurgalılar | |
| Hemoglobin β alt birimi | ||
|---|---|---|

| ||
| PDB 1GZX'e göre hem, demir (yeşil) ve dioksijen içeren hemoglobin β alt biriminin hem cebinin küre modeli | ||
|
Mevcut yapısal veriler : UniProt girişi | ||
| İnsan proteininin özellikleri | ||
| Kütle / uzunluk birincil yapısı | 146 amino asit | |
| kofaktör | hamam | |
| tanımlayıcı | ||
| gen adı | HBB | |
| Harici kimlikler | ||
| oluşum | ||
| homoloji ailesi | Beta-2 globin | |
| ana takson | Omurgalılar | |
| ebeveyn |
| sitozol |
| Gen ontolojisi |
|---|
| QuickGO |
Hemoglobin ( eski Yunanca αἷμα haíma , "kan" ve Latince globus , "yumru, top"), kısaltma Hb , omurgalıların kırmızı kan hücrelerinde kan pigmenti olarak bulunan, oksijeni bağlayan demir içeren protein kompleksidir . ve kan dolaşımında taşır .
Memelilerin hemoglobini bir tetramerdir , alt birimler olarak dört globinden oluşur . Yetişkinlerde, en yaygın şekli olan hemoglobin A'da (Hb A 0 ) iki Hb α ve Hb β vardır . Dört protein oluşturan karmaşık olan amino asit zincirleri (α zinciri 141 AA , her biri globinlerine kıvrım tipik bir cebi olan bir demir (II) 'de, β zinciri 146 AA) kompleksi , heme , bağlıdır. Demir iyonu bir oksijen molekülünü bağlayabilir. Hem rengi koyudan açık kırmızıya değişir. Bağın gücü , heme'nin protein ortamının konformasyonuna duyarlıdır . Dört globin arasındaki etkileşimler, tüm kompleksin ya dört oksijen molekülüyle ( akciğerlerde veya solungaçlarda ) doyurulduğu ya da tüm oksijeni bıraktığı iki uç durumu destekler . Diğer moleküllerle etkileşimler hem yüklemeyi hem de boşaltmayı destekler.
Hayvanlar aleminde hemoglobin ve benzeri globinlerin oluşumu hakkında bilgi için bkz. Oksijen Taşıyıcı .
Öykü
Oksijen taşıma proteini hemoglobin, 1840 yılında Friedrich Ludwig Hünefeld tarafından keşfedildi. 1851'de Otto Funke, hayvan kanını su, etanol veya dietil eter ile seyrelterek ve daha sonra elde edilen protein solüsyonundan çözücüyü yavaşça buharlaştırarak ("Funkesche kristalleri") hemoglobinin kristalleşmesini tanımladı. Hemoglobinin geri dönüşümlü oksijenasyonu ilk kez 1866'da Felix Hoppe-Seyler tarafından rapor edildi . Hemoglobin adı da ondan geliyor. Hem'in (veya karşılık gelen hem'in) yapısal formülü, yani demir içeren porfirin kompleksi, 1912 gibi erken bir tarihte Alman kimyager William Küster tarafından formüle edildi ve kimyager Hans Fischer, bu yapısal formülün doğruluğunu kanıtlayabildi. 1928, heme'nin tam sentezi yoluyla. 1930'da bunun için Nobel Kimya Ödülü'ne layık görüldü . Hemoglobin, en iyi çalışılan proteinlerden biridir; yapısı , 1959'da Max Perutz ve arkadaşları tarafından X-ışını kristalografisi yardımıyla belirlenen ilk proteinlerden biriydi . Bu çalışması için 1962'de John Kendrew ile birlikte Nobel Kimya Ödülü'nü aldı .
yapı
Değiştirilmemiş temel yapı
Hemoglobin A'nın şerit modeli (HbA) -
iki alt birim α ve β (kırmızı ve mavi) her biri bir prostetik grup olarak bir heme (çubuk modeli, yeşil) taşır (PDB 1GZX'e göre )
Memeli hemoglobinleri , her biri iki α- ve iki β-tipi olmak üzere dört alt birimden oluşur . Bu alt birimlerin her birinde , oksijen bağlanmasının gerçekleştiği bir protez grubu gömülüdür. Bir hemoglobin kompleks molekülü bu nedenle dört oksijen molekülünü bağlayabilir. Oksijensiz formun protez grubu , demir iyonunun dört ekvator pozisyonunu işgal eden protoporfirin IX'un bir demir (II) kompleksidir. Demir iyonu yüksek spin durumundadır ve bu nedenle porfirin deliğine sığmayacak kadar büyüktür. Yani halka seviyesinin biraz altında. Bu hem b , proksimal histidin tortusu yoluyla alt taraftaki demir iyonunun eksenel konumu aracılığıyla protein matrisine bağlanır . Üstteki ikinci eksenel pozisyon boştur ve oksijen molekülünün bağlanması için uygundur.
Çeviri sonrası değişiklikler
İnsanların hemoglobin alt birimlerindeki bireysel amino asitlerin çeşitli nadir modifikasyonlarına ek olarak , her iki alt birimin özel amino asitler üzerinde glikasyonu sıklıkla meydana gelir . Bu, kandaki yüksek glikoz konsantrasyonunun bir sonucudur ve bu nedenle son birkaç aydaki ortalama kan şekeri seviyesini belirlemek için laboratuvar tanılarında kullanılabilir .
Hemoglobinin glikasyonu sırasında, glikoz , α-alt biriminin lizin -8, -17, -41, -62'ye ve ayrıca valin -2, lisin-9, -18, -67, -121'e kovalent olarak bağlanır veya - β-alt birimin 145'i bağlı. Glikasyonlu bir β-hemoglobin valin-2'de modifiye edilirse ve glikoz tortusu, bir aldimin ve bir Amadori yeniden düzenlemesi yoluyla stabil bir ketoamine dönüştürülürse, buna HbA1c olarak atıfta bulunulur .
oksijen taşıma
Yeterlik
Hemoglobin, suda çok iyi çözünürlüğe sahip küresel bir proteindir (5 mmol / l hemoglobine (% 34) kadar çözünürlük ). 1 g Hb, in vitro olarak 1.389 ml oksijen bağlayabilir, ancak in vivo olarak yalnızca 1.34 ml ( Hüfner sayısı ), bu nedenle yaklaşık 15 g Hb içeren 100 ml kan, yüzde 100 doygunlukta 15 × 1.34 ml'ye kadar tutabilir = 20.1 Absorbe ml oksijen.
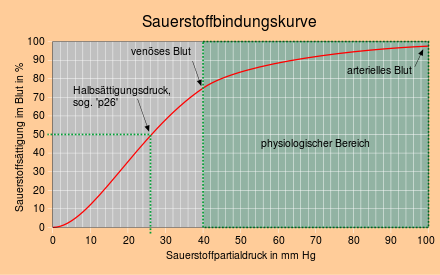
Bağlanma eğrisinin sigmoidal (S-şekilli) seyri dikkat çekicidir. Normal olarak, oksijen yükünün , miyoglobin durumunda olduğu gibi (hiperbolik seyir) olduğu gibi , oksijen kısmi basıncının artmasıyla oksijen yükünün başlangıçta keskin bir şekilde artması ve daha sonra daha yavaş artması beklenir . Hemoglobin için, oksijen bağlama eğrisi, akciğerlerde hakim olan oksijen kısmi basıncı alanında alışılmadık şekilde düzdür ve dokuda hakim olan oksijen kısmi basıncı alanında alışılmadık şekilde diktir. Bağlanma eğrisinin uç kısımdaki düz seyri, yaşlılıkta, akciğer fonksiyon bozukluğu olanlarda ve yüksek irtifalarda oksijen satürasyonunun daha fazla düşmesini engeller ve orta kısımdaki daha dik seyir, venöz oksijen geldiğinde çok fazla oksijenin salınmasını sağlar. kısmi basınç düşüşleri.
Normal alan
Yetişkinlerde baskın olan "yetişkin hemoglobini" (aşağıya bakınız) için normal bir aralık belirlenmiştir. Diğer standart değerler çocuklar için geçerlidir.
Normal aralık sağlıklı insanların 96 yüzde Hemoglobin değerleri olduğu aralıktır.
| g / dl (eski birim) |
mmol / l ( SI birimi ) |
|
|---|---|---|
| erkekler | 13.5-17.5 | 8.4-10.9 |
| Kadınlar | 12-16 | 7.4-9.9 |
| Yeni doğan | 19. | 11.8 |
Artan bir hemoglobin değeri genellikle aynı zamanda artan sayıda eritrosit ( poliglobuli ) anlamına gelir ve örn. B. Yüksek irtifalarda kalındığında (oksijen eksikliği) veya sıvı kaybı nedeniyle oluşur. Sebep belirsiz ise önemli derecede artan değerlerin polisitemi vera hastalığına bağlı olup olmadığı da açıklığa kavuşturulmalıdır .
Hemoglobin düzeyinin azalmasına anemi , kırmızı kan hücrelerinin hemoglobin ile yükünün azalmasına hipokromazi denir .
Artan / azalan hemoglobin değeri her zaman normal değere bağlıdır. Normal değer, 10.9 mmol / L, 8.4 mmol'lük bir değerse / l olabilir yol için semptomlar arasında anemi . Normal değer 9 mmol/l ise 8.4 mmol/l'de herhangi bir belirti oluşmaz.
Kan bağışının onaylanmasında hemoglobin değerinin seviyesi belirleyicidir . Donör doktor tarafından onaylanabilmesi için erkeklerde minimum 8,4 mmol/l (13,5 g/dl), kadınlarda ise 7,8 mmol/l (12,5 g/dl) olması gerekir. Hb değeri, elektronik olarak ölçülen bir Hb fotometresi kullanılarak belirlenir . DRK kan bağışı servisinden alınan güncel bilgiler, Hb'si > 11,2 mmol / l (18,0 g / dl) olan erkeklerin artık bağış yapmasına izin verilmediğini söylüyor (12/2006). Ancak tüm federal eyaletlerde durum böyle değildir; Hb değeri yükselirse bağıştan önce daha fazla sıvı alımı önerilir.
Hemoglobin içeriğinin belirlenmesi, proteinin hem gruplarının saptanmasına dayanır. Bu nedenle molar hemoglobin konsantrasyonu geleneksel olarak (burada da) bireysel alt birimlerin konsantrasyonudur (ortalama molar kütle : 16114.5 g / mol). Bu nedenle g / dl'den mmol / l'ye dönüştürme faktörü 0,6206'dır. IUPAC ve DIN 58931'e göre bu şekilde hesaplanan (monomerik) hemoglobin konsantrasyonu Hb (Fe) olarak adlandırılır . Bir hemoglobin kompleks molekülü, her biri bir hem grubu olan 4 alt birimden oluştuğundan, hemoglobin tetramerinin (IUPAC ve DIN'e göre Hb olarak adlandırılır) konsantrasyonunu elde etmek için mmol / l cinsinden verilen değerlerin 4'e bölünmesi gerekir. 58931 ) (molar kütle: 64458 g/mol). Bu nedenle g / dl'den mmol / l'ye dönüştürme faktörü 0.1551'dir. g/dl cinsinden verilen değerler değişmeden kalır.
Moleküler düzeyde hemoglobinler aracılığıyla oksijen bağlanması
Oksijen bağlandığında, hem kompleksinin merkezine bir dioksijen (O 2 ) molekülü emilir. Merkezi demir iyonunun (Fe II ) atomu , oksijen bağı nedeniyle düşük dönüşlü bir duruma dönüşür . Bu süreçte boyutu küçülür ve porfirin halkasının düzlemine kayar.
Bağlı oksijen molekülü, bir hidrojen köprüsü vasıtasıyla stabilize edilir . Bu, globin proteininin yan zinciri ile oluşturulur : merkezi atomun yakınında bulunan bir uzak histidin kalıntısı . Hem demir atomunun protein matrisine bağlandığı proksimal histidin kalıntısı, halka düzleminin diğer tarafında yer alır.
Oksijen bağlanması üzerinde işbirlikçi etki
Dört Hb alt biriminden oluşan bir hemoglobin, dört oksijen molekülünü bağlayabilir. Tamamen istatistiksel değerlendirmeler için, halihazırda bağlı olan her oksijen molekülü ile daha fazla oksijen molekülünü bağlama çabasının azalması beklenir. Ancak yapılan çalışmalar bunun tam tersi olduğunu ve artan yük ile oksijen afinitesinin arttığını (pozitif kooperativite ) göstermiştir.
oksijen bağlanmasının pH değerine bağımlılığı
R- ve T-formu arasındaki denge pH'a bağlıdır ( Bohr etkisi ) ve protonasyon ile düşük bir pH değerinde daha az oksijene afin T-formu lehine kaydırılır. Aynı etki, bir BASKAK 2 - kısmi basıncının bir tersinir ile karboksilasyon alt birimlerinin. Yüksekten Bu yol açar , proton ve karbon dioksit gibi, örneğin bulunanlara benzer konsantrasyonlarda, B. Çalışan kasta hücresel solunum ve laktik asit fermantasyonu yoluyla hakim olur, hemoglobinin tamamen boşalmasını destekler.
Oksijen ve karbon monoksit arasındaki rekabet
Karbon monoksit (CO), demir merkezlerinin eksenel koordinasyon noktaları için oksijenle rekabet ettiği için çok zehirlidir. Bir kez bağlandığında, CO örn. B. sadece bir basınç odasında oksijen basıncı tedavisi ile yer değiştirebilir - bu nedenle oksijen için bağlanma bölgelerini bloke eder. Ağır sigara içicilerinde, hemoglobinin yüzde 10'a kadarı CO tarafından işgal edilir. Karbon monoksit
serbest heme b'ye dioksijenden 25.000 kat daha güçlü bir şekilde bağlanır, ancak hemoglobinde sadece 200 kat daha güçlüdür. CO afinitesinin azalmasının nedeni, distal histidinin gerektirdiği boşluk nedeniyle karbon monoksit tarafından tercih edilen lineer Fe-CO koordinasyonunun mümkün olmamasıdır.
Oksijen bağlanmasını etkileyen etkiler
Oksijen bağlama eğrisi, apsis üzerinde sağa kaydırılır:
- Sıcaklık artışı
- Uğrayın pH
- Konsantrasyonunda artış 2,3-bifosfogliserat içinde eritrositler
- Karbondioksit konsantrasyonunda artış
Sağa kaydırma hemoglobin yapar daha kolay oksijen salan . Bir örnek: Bir çalışma kas için oksijen çok ihtiyacı var sözleşme . Enerjinin bir kısmını ısıya dönüştürdüğü için çalışan kaslarda sıcaklık yükselir. Ayrıca laktik asit salgılar ve pH değeri düşer. Artan metabolizma daha fazla karbondioksit üretir: lokal etkiler, kasların kandan daha fazla oksijen almasına izin verir.
- Kaslarda oksijen için daha yüksek bir afiniteye sahip olan (daha fazla oksijen çeken) miyoglobin (aşağıya bakınız) bulunur. Oksijen deposu görevi görür.
Oksijen bağlama eğrisi, apsis üzerinde sola kaydırılır:
- Sıcaklık düşüşü
- pH artışı
- Eritrositlerde 2,3-bifosfogliserat konsantrasyonunda azalma
- Karbondioksit konsantrasyonunda azalma
Sol shift daha sıkı bağlamak oksijene hemoglobin neden olur. Bu yapılır z. B. kanını oksijenle maksimum düzeyde doyurmak için hipotermi ile kalp ameliyatlarında. Kış uykusuna yatan hayvanlar da bu etkiden yararlanır. Akciğerlerde, ekshalasyon sırasında karbondioksitin bir kısmı salınır - Hb oksijenle daha kolay yeniden yüklenebilir.
2,3-bifosfogliserat oluşan enzim tarafından bifosfogliserat mutaz içinde Rapoport-Luebering döngüsü (glikoliz baypas hattında) çok önemlidir ara madde olarak glikoliz kırmızı kan hücreleri. Hemoglobine bağlanır ve allosterik etkiye neden olur ; hemoglobinin oksijene afinitesinin azalması. Organizmada oksijen salınımını sağlamak hayati önem taşır. Fizyolojik koşullar altında, 2,3-BPG kırmızı kan hücrelerinde hemoglobin ile yaklaşık olarak aynı konsantrasyonda bulunur. 2,3-BPG konsantrasyonundaki bir artış örn. B. Yükseklik ayarı sırasında dikkat edilmesi gereken. Bu düzenlemenin amacı aşağıdaki gibidir: Yüksek irtifada "ince hava" ile kandaki oksijen doygunluğu azalırsa, Hb bağlı oksijeni tüketiciye yüksek doygunluğa göre daha zayıf bir şekilde bırakır (bağlanma eğrisine bakınız). Bununla birlikte, tüm organların O2 ile beslenmesi garanti edilmelidir . Dolayısıyla, çevreyi yeterince beslemek için Hb'nin oksijene daha az afinitesi olması gerekir .
Hemoglobin türleri
İnsanlarda yaşamın farklı evrelerinde (embriyonik evre, cenin evresi ve doğumdan sonra, yani "yetişkin evresi") farklı hemoglobinler bulunabilir. Bu hemoglobinler oksijene olan afiniteleri bakımından farklılık gösterirler. Her biri farklı kompozisyon çiftlerinde dört alt birimden oluşur.
Tarihsel olarak, hemoglobinin farklı alt birimleri , globin geninin kopyalanmasıyla yaratılmıştır . Bu alt birimlerin tetramer olarak kombinasyonları, örneğin anne karnındaki bir fetüs olarak anne kanından oksijen elde etmek için oksijen ihtiyacına bağlı olarak farklı zamanlarda sentezlenir .
Hamilelik sırasında oksijen, plasenta ( plasenta ) yoluyla fetüse taşınır ve daha sonra onu verimli bir şekilde alır. Bu, embriyonik ve fetal hemoglobin tiplerinin, doğumdan sonra oluşan yetişkin hemoglobininden önemli ölçüde daha yüksek oksijen bağlama afinitesine sahip olmasıyla sağlanır. Ek olarak, hematokrit anneye göre oldukça yüksektir. Bu, göbek kordonu yoluyla fetüse yeterli oksijenin ulaşmasını sağlar.
embriyonik hemoglobinler
Embriyonik hemoglobinler kan Adaları, ilk 8 hafta sonra gübreleme, embriyonik aşamada oluşan yolk kesesi ve isimleri vardır:
- Gower-1 (ζ 2 ε 2 ) ("zeta-epsilon")
- Gower-2 (α 2 ε 2 ) ("alfa-epsilon")
- Portland-1 (ζ 2 γ 2 ) ("zeta-gamma")
- Portland-2 (ζ 2 β 2 ) ("zeta-beta")
fetal hemoglobinler
Olarak fetal hemoglobin (doğum kavramı sonra 9 haftadan) olarak adlandırılır hemoglobin F (HbF) esas olarak fetal dönemde oluştu. Fetal hemoglobin sentezi önceki embriyonik fazda başlar ve doğumdan hemen sonra durmaz, birkaç ay devam eder. Oluşum yeri karaciğer ve dalaktır . Anne kanından oksijeni almak için yetişkin hemoglobininden çok daha yüksek oksijen afinitesine sahiptir.
- Hemoglobin F (α 2 γ 2 ) - Fetüsteki baskın hemoglobin, sadece sağlıklı yetişkinlerde eser miktarda saptanabilir
Yetişkin hemoglobinler
Yetişkin hemoglobin olan hemoglobin (α 2 β 2 ; HbA 0 [eski Hb olarak adlandırılan 1 , tasvir HbA 1c bir glikozile biçimde açılımı]) ve hemoglobin 2 (α 2 δ 2 ; HbA 2 ). Yetişkin hemoglobinlerinin sentezi fetüste başlar ve doğumdan sonraki ilk birkaç ayda fetal hemoglobinin yerini alır. Oluşum yeri kemik iliğidir . Yaşamın ilk yılında, γ geninin ekspresyonu azalır ve β geninin ekspresyonu artar. Transkripsiyon faktörü BCL11A erişkinlerde γ-globin belirleyici baskılayıcı olduğunu. Bu nedenle, fetal hemoglobin yetişkinlerde sadece eser miktarda saptanabilir.
- Hemoglobin A (α 2 β 2 ) - %98
- Hemoglobin A 2 (α 2 δ 2 ) -% 2.
Glikohemoglobinler
Glikohemoglobinler, glikozun globinlerin amino gruplarına bağlanmasıyla oluşturulur . Fizyolojik koşullar altında bu, hemoglobinin kan şekeri ile teması ( glikasyon ) yoluyla enzimatik olmayan bir şekilde gerçekleşir . Hemoglobin A'nın ana bileşeni HbA 0 , esas olarak , glikozun β zincirinin N- terminal amino asit valine bağlandığı HbA 1c'ye dönüştürülür . HbA 1c'nin toplam hemoglobindeki ilgili oranı , son birkaç haftadaki ortalama kan şekeri seviyesinin bir göstergesi olarak yorumlanır.
methemoglobin
Methemoglobin (Met-Hb), demir iyonunun II yerine III oksidasyon seviyesinde olduğu, hemoglobinin deaktive edilmiş, oksijene afin olmayan bir formudur. NADH bağımlı enzim methemoglobin redüktaz (Diaphorase I) hemoglobin içine methemoglobin geri dönüştürme yapabiliyor. Tipik olarak, insan hemoglobininin yüzde ikisi methemoglobindir. Daha yüksek bir oran ya genetik olabilir ya da zehirlenme sonucu olabilir. Yüksek oranda methemoglobin, organizmaya yetersiz oksijen tedariki ile sonuçlanır.
Hemoglobinin parçalanması
Kırmızı kan hücreleri yaşamlarının sonuna (yaklaşık 120 gün) ulaştığında, mononükleer fagositlerde, özellikle dalakta (ve yüksek düzeyde bozunabilir hemoglobin varsa karaciğer ve kemik iliğinde) parçalanırlar. Parçalanma süreci dalakta başlar ve karaciğerde devam eder. İlk olarak, globin kısmı hemden ayrılır ve amino asitlere indirgenir. Hem , demir (Fe 2+ ) ve karbon monoksit salınarak sitokrom P450'ye bağlı bir oksijenaz ( hemooksijenaz ) yoluyla biliverdine bölünür . Demir, makrofajlar tarafından kanda bulunan taşıma proteini transferrine salınır . Biliverdin redüktaz nihayet içine yeşilimsi biliverdin dönüştürür bilirubin . Bu kana salınır ve albümine bağlanır (çünkü suda az çözünür) ve karaciğere taşınır. Burada bilirubin olan konjuge ile iki kez glukuronik asit ve böylece çözünür hale - şimdi salınabilir içine bağırsak ile safra ve dışkı ile atılır. Bağırsakta bakteri glukuronik asit, kısmen tekrar bozuldu sağlamak ve bu şekilde turuncu bilirubin renksiz indirgenir urobilinogen ve kahverengi sterkobilinogen . Bu indirgenmiş bilirubinin küçük bir kısmı tekrar bağırsak (enterohepatik dolaşım) yoluyla alınır ve böbrekler ( idrarın sarı rengi ) yoluyla atılır . Karaciğer iltihabı ( hepatit ) veya safra kesesindeki drenajın tıkanması (safra taşları) gibi çeşitli karaciğer hastalıkları, bilirubin konsantrasyonunun artmasına neden olur. Bilirubin, ciltte biriktiğinde sarılığa (sarılık = derinin ve gözlerin dermisinin ( sklera ) sararmasına) yol açan pigmenttir .
Hastalıktaki rolü
Mutasyonlar içinde HbA1C - gen için α-alt birimi kusurlar ve bu olabilir Heinz organları - anemi ve α-talasemi yol açar. HBB genindeki mutasyonlar, Heinz vücut anemisine, β-talasemiye ve orak hücreli anemiye neden olabilir . HBG1 / HBG2 genlerinin bazı varyantları yenidoğan sarılığına neden olabilir.
Kırmızı kan hücresi sayımlarında azalma olsun veya olmasın düşük hemoglobin seviyeleri, anemi semptomlarına yol açar . Aneminin birçok nedeni vardır ve batı dünyasında demir eksikliği en yaygın nedendir. Hem sentezi demir eksikliği ile inhibe edilir. Sonuç olarak, kırmızı kan hücreleri hipokromik (kırmızı renkten yoksun) ve mikrosikiktir (normalden daha küçüktür).
İle hemoliz (kırmızı kan hücrelerinin artan dökümü), sarılık , hemoglobin neden oluşur metabolit bilirubin . 135 mg/dl miktarına kadar kan damarlarında salınan hemoglobin haptoglobine bağlanır; kan ağır düşerse kanda serbest hemoglobin ortaya çıkar ( hemoglobinemi ).
Bilinen genetik kusurların bir grup porfiri heme sentezini bozabilir. Hem öncüllerinin birikmesi, diğer şeylerin yanı sıra , ışığa duyarlılık, karın ağrısı ve nörolojik problemlerin yanı sıra porfirinüri ile sonuçlanır .
Methemoglobinemide, oksijen taşımak için kullanılan kırmızı kan hücrelerinde bulunan hemoglobin, işlevsel olmayan methemoglobine dönüştürülür ve bu nedenle artık oksijen taşınması için kullanılamaz. Bunun nedeni kalıtsal olabilir ( doğuştan methemoglobinemi ) veya toksinler tarafından tetiklenebilir.
Globin zincirlerindeki mutasyonlar, orak hücreli anemi ve talasemi gibi çeşitli hemoglobinopatilerle ilişkilidir .
Sıtma patojenleri , kendi metabolizmaları için protein üretmek üzere enfekte oldukları kırmızı kan hücrelerinde hemoglobini parçalarlar. Hem , parazit tarafından kristalize edilen ve mikroskop altında enfekte eritrositlerde bir pigment olarak görülebilen hemozoini oluşturur . Sıtma ilacı klorokin bu kristalleşmeyi engeller ve parazit heme tarafından zehirlenir.
kanıt
Hemoglobin, kanın sofra tuzu ve buzlu asetik asit ile dikkatlice ısıtıldığı Teichmann testi kullanılarak tespit edilir , burada hemin (Teichmann kristalleri) çökeltilir veya bir luminol ve sodyum hidroksit çözeltisinin ve bir hidrojen peroksit çözeltisi kullanılır. Bu reaksiyon sadece bir katalizör varlığında gerçekleşir; hemoglobin tespit edilirse, bu hem kompleksindeki demir (II) iyonu olacaktır.
Sanat ve Müzikte Hemoglobin

- 2005 yılında, Alman-Amerikalı sanatçı Julian Voss-Andreae , hemoglobin yapısına dayanan bir heykel yarattı. İşin amaçlanan paslanması, heme'deki oksijenasyona bir imadır.
- İngiliz rock grubu Placebo Hemoglobin adlı bir şarkı kaydetti .
- Fransız rapçi MC Solaar , 1994 yılında La concubine de l'hémoglobine adlı başarılı bir single yayınladı .
- Alman melodik death metal grubu Deadlock , "The Arrival" adlı albümlerinde 11 dakikalık "Killing The Time With Hemoglobin" adlı bir şarkıya sahip.
Bireysel kanıt
- ^ Friedrich Ludwig Hünefeld: Hayvan organizasyonunda kimya. Brockhaus, 1840 ( Google kitap aramasında sınırlı önizleme ).
- ↑ Protein Kristallografisi İçin Bir NASA Tarifi. (PDF; 782 kB) İçinde: Eğitim Özeti. Ulusal Havacılık ve Uzay Dairesi, 2 Şubat 2016'da erişildi .
- ↑ F. Hoppe-Seyler: Canlı kandaki oksidasyon hakkında . İçinde: Med-kimya Sınav Laboratuvarı . kaset 1 , 1866, s. 133-140 .
- ↑ Georg Hoppe-Seyler: Felix Hoppe-Seyler - doktor ve doğa bilimci .
- ^ William Küster: Bilirubin ve hämin bilgisine katkılar. İçinde: Hoppe-Seyler'in Fizyolojik Kimya Dergisi . 82, 1912, s. 463 vd.
- ↑ MF Perutz, MG Rossmann, AF Cullis, H. Muirhead, G. Will, ACT North: Structure of H . İçinde: Doğa . kaset 185 , hayır. 4711 , 1960, s. 416-422 , doi : 10.1038/185416a0 , PMID 18990801 .
- ^ MF Perutz: Hemoglobinin yapısı . İçinde: Biyolojide Brookhaven sempozyumları . kaset 13 Kasım 1960, ISSN 0068-2799 , s. 165-183 , PMID 13734651 .
- ↑ MF Perutz, H. Muirhead, JM ve Cox ve diğ .: 2,8 A çözünürlükte oksihemoglobin at üç boyutlu Fourier sentezi: (1) X-ışını analizi . İçinde: Doğa . kaset 219 , hayır. 5149 , Temmuz 1968, s. 29-32 , doi : 10.1038/219029a0 , PMID 5659617 .
- ^ MF Perutz, H. Muirhead, JM Cox, LC Goaman: 2.8 A çözünürlükte at oksihemoglobininin üç boyutlu Fourier sentezi: atomik model . İçinde: Doğa . kaset 219 , hayır. 5150 , Temmuz 1968, s. 131-139 , PMID 5659637 .
- ↑ HbA1c ve Glikatlı Hemoglobin ( İnternet Arşivinde 29 Ocak 2012 Memento ) Canterbury Scientific.
- ↑ UniProt P69905 , UniProt P68871
- ↑ JM Berg, JL Tymoczko, L. Stryer: Biyokimya. 6. baskı. Spektrum Akademischer Verlag, Münih 2007, ISBN 978-3-8274-1800-5, s. 208ff.
- ^ Robert F. Schmidt, Gerhard Thews (ed.): İnsanların fizyolojisi . 25. baskı. Springer-Verlag, Berlin 1993, ISBN 3-541-02636-7 , s. 616-620 .
- ↑ Erich Schütz, Heinz Caspers, Erwin-Josef Speckmann (ed.): Fizyoloji . 16. baskı. Urban & Schwarzberg, Münih 1982, ISBN 3-540-57104-3 , s. 86-87 .
- ↑ a b c d R. Zander, W. Lang, P. Lodemann: Hemoglobinin moleküler ağırlığı . 13 Ağustos 2013 alındı.
- ↑ GS Adair: Hemoglobin sistemi VI. Hemoglobinin oksijen ayrışma eğrisi. İçinde: J Biol Chem . Cilt 63, 1925, s. 529-545.
- ↑ DE Koshland, G. Némethy, D. Filmer: Alt birimler içeren proteinlerde deneysel bağlanma verilerinin ve teorik modellerin karşılaştırılması. İçinde: Biyokimya . Cilt 5, Sayı 1, Ocak 1966, sayfa 365-385, ISSN 0006-2960 . PMID 5938952 .
- ^ Pschyrembel Çevrimiçi. 29 Temmuz 2021'de alındı .
- ↑ Fetal Pozisyonda Hemoglobinopatiler | NEJM. 31 Ocak 2019'da erişildi .
- ^ Vijay G. Sankaran, Tobias F. Menne, Jian Xu, Thomas E. Akie, Guillaume Lettre: İnsan fetal hemoglobin ekspresyonu, gelişim evresine özgü baskılayıcı BCL11A tarafından düzenlenir . İçinde: Bilim (New York, NY) . kaset 322 , hayır. 5909 , 19 Aralık 2008, ISSN 1095-9203 , s. 1839-1842 , doi : 10.1126 / bilim.1165409 , PMID 19056937 .
- ↑ UniProt P69905 , UniProt P68871 , UniProt P69891
- ↑ Wolfgang Piper: Dahiliye . 2. Baskı. Springer, Berlin 2002, ISBN 978-3-642-33108-4 , s. 639-640 .
- ↑ Constance Holden: Kan ve Çelik . İçinde: Bilim . kaset 309 , hayır. 5744 , 30 Eylül 2005, s. 2160 , doi : 10.1126 / science.309.5744.2160d ( sciencemag.org [PDF]).
- ↑ L. Moran, RA Horton, G. Scrimgeour, M. Perry: Principles of Biochemistry . Pearson, Boston, MA 2011, ISBN 978-0-321-70733-8 , s. 127 .
Edebiyat
- MF Perutz: Hemoglobinde işbirlikçi etkilerin stereokimyası. İçinde: Doğa. Cilt 228, Sayı 5273, Kasım 1970, s. 726-739, ISSN 0028-0836 . PMID 5528785 .
- L. Makowski, J. Bardhan ve ark.: Çözeltideki hemoglobinin yapısal çeşitliliğine ilişkin WAXS çalışmaları. In: Journal of Molecular Biology , Cilt 408, Sayı 5, Mayıs 2011, s. 909-921, ISSN 1089-8638 . doi: 10.1016 / j.jmb.2011.02.062 . PMID 21420976 . PMC 3081904 (ücretsiz tam metin).
- T. Yonetani, M. Laberge: Protein dinamiği, hemoglobinin allosterik davranışlarını açıklar. In: Biochimica et biophysica acta , Cilt 1784, Sayı 9, Eylül 2008, sayfa 1146-1158. doi: 10.1016 / j.bbapap.2008.04.025 . PMID 18519045 . PMC 2668241 (serbest tam metin). (Gözden geçirmek).
- Martin D. Vesper, Bert L. de Groot, Dennis R. Livesay: Hemoglobin'de Allosterik Geçişlerin Altında yatan Kolektif Dinamikler. İçinde: PLoS Hesaplamalı Biyoloji. Cilt 9, 2013, Makale e1003232, doi: 10.1371 /journal.pcbi.1003232 .
İnternet linkleri
- Hemoglobinin Etkileşimli 3D Modeli - Proteopedia
- Ayın molekülü: hemoglobin (ingilizce)
- Jennifer McDowall / Interpro: Ayın Proteini: Hemoglobin. (ingilizce)