Kedi bulaşıcı peritonit
Kedi bulaşıcı peritonit ( FIP ) bir gereğidir Kedi koronavirüs kaynaklı enfeksiyon hastalıkları , sadece kediler (Felidae) saldırıları. Adı, en yaygın klinik tezahür olan bir peritonitten ( peritonit ) türetilmiştir . Bununla birlikte, sadece plevra etkilenebilir, bu nedenle kedi enfeksiyöz poliserozit adı nadiren kullanılır. Ek olarak, seroza (vücut boşluklarının astarı) tutulumu olmadan da klinik bir tablo ortaya çıkabilir . Hastalık dünya çapında görülür. Hastalığın klinik bir belirtisi varsa, genellikle ölümcüldür. Sırasıyla 2016 ve 2018'den bu yana, FIP'yi tedavi etmek için çeşitli çalışmalarda başarıyla kullanılan iki yeni deneysel aktif madde (GC376 ve GS-441524) bulunmaktadır. Bu aktif maddeler AB'de onaylanmadığından, bunların ithal edilmesi Bölüm 96 No. 4 AMG'ye göre ceza gerektiren bir suçtur.
Neden ve epidemiyoloji
FIP'nin nedeni oldukça öldürücü bir koronavirüstür . Şimdi Feline Coronavirus ( FCoV ) olarak bilinen virüs, 1990'ların sonunda iki farklı virüse bölündü: " Feline Enteral Coronavirüs " (FECV) olarak adlandırılan daha az patojenik ve yüksek derecede patojenik " Feline Enfeksiyöz Peritonit Virüsü " (FIPV). Sonuncusu sadece taşıyıcı hayvan içindeki "FECV"nin bir mutasyonudur . Her ikisi de şu anda Alphacoronavirus 1 virüs türünün bir alt tipi veya izolatı olarak sınıflandırılmaktadır . FIPV, insan koronavirüsü 229E ve domuz ve köpeklerin koronavirüsleri ile antijenik olarak ilişkilidir. İnsan koronavirüsü OC43 ve sığır ve fare koronavirüsleri ile ilgili değildir.
Mutasyon , viral gen 3C'deki bir silmeden oluşur , ancak bu her zaman aynı yerde gerçekleşmez. Değişiklik, viral RNA polimerazın kesin olmayan çalışmasıyla desteklenir , bu da replikasyon sırasında 1.000 ila 10.000 nükleotit başına yanlış birleştirilmiş bir nükleotit ile sonuçlanır . Virüs RNA'sının toplam uzunluğu yaklaşık 30.000 nükleotit olduğunda, virüsün genetik materyalindeki replikasyon başına üç mutasyon "normal"dir.
FCoV dünya çapında görülür, ancak seropozitif (enfekte) evcil kedilerin yalnızca yüzde 5-10'u FIP hastalığı geliştirir. Tüm kedi popülasyonu ile ilgili olarak, FIP yüzde 1-2'lik bir oluşum sıklığına ( prevalans ) sahiptir. Serolojik olarak iki virüs tipi arasında bir ayrım yapılmakta olup, esas olarak Avrupa ve ABD'de ortaya çıkan tip 1, esas olarak Japonya'da görülen tip 2 ile mümkün olmayan hücre kültürlerinde çoğaltılabilmektedir.
Kuluçka süresi en fazla dört aya muhtemelen. Enfeksiyondan sonraki ikinci gün gibi erken bir tarihte hayvanlar, virüsü dışkıları, burun salgıları ve tükürükleriyle salgılarlar. Virüs bulaşması ömür boyu sürebilir. Başlangıçta zararsız olan virüs, esas olarak enfekte dışkı veya kontamine nesnelerle temas yoluyla bulaşır. Ağızdan ağza veya ağızdan buruna bulaşma da mümkündür. Çevrede, virüs bir haftaya kadar bulaşıcıdır. Ek olarak, insanlar virüsü taşıyabilir ve kedilere geçirebilir. Virüs taşıyan kedi anneleri genellikle hamilelik sırasında fetüslerini enfekte eder . Halihazırda mutasyona uğramış formun bulaşması muhtemelen hastalığın yayılmasında bir rol oynamaz.
Prensip olarak, tüm kedi türleri ve yaş grupları FIP'ye duyarlıdır. Hastalık en sık altı ay ile beş yaş arasındaki hayvanları ve 14 yaşından büyük hayvanları etkiler. Vahşi doğada yaşayan kediler çoğunlukla kalıcı dışkıları olmayan yalnız yaratıklar olduğundan, vahşi hayvanların enfekte olma olasılığı çok daha düşüktür. Yakalanan vahşi evcil kediler, bir hayvan barınağında birkaç hafta sonra, diğer yandan hayvanların neredeyse yüzde 90'ı kadar seropozitiftir. Gelen büyük kediler özellikle büyük stokları da vardır hayvanat bahçeleri tehlikede leoparlar özellikle duyarlı olarak kabul edilir.
Patogenez ve formlar
Patogenezi hastalığın henüz tam olarak açıklık kazanmış değil. Başlangıçta zararsız olan FCoV varyantının sözde "FIP virüslerine" mutasyonu bağırsakta gerçekleşir ve enfeksiyondan yıllar sonra ortaya çıkabilir. Mutasyon ile virüs , bağışıklık sisteminin fagositlerinin ribozomlarına ( monositler ve makrofajlar ) bağlanma ve bunlarda çoğalma ( replikasyon ) yeteneği kazanır . Virüs replikasyonu fagositlerin bozulmasına neden olur ve salınan virüs partikülleri diğer fagositler tarafından alınır ve bu da virüsün tüm vücuda yayılmasına neden olur. Hücre haberci maddelerinin salınması , kan damarlarını kaplayan hücreleri ( endotelyal hücreler ) harekete geçirir ve böylece iltihaplanmaya yol açar . Bazı hücre habercileri , lenfositler gibi diğer bağışıklık hücrelerinin ölümüne de yol açar . Mutasyona uğramamış varyantı, diğer taraftan, ağırlıklı olarak üretir ve bağırsak epitel hücreleri jejunum .
Bugün, hastalığın nihai olarak ortaya çıkıp çıkmadığı ve hangi biçimde ortaya çıktığı, bireysel hayvanın bağışıklık durumuna bağlı olduğu varsayılmaktadır.
Bazı hayvanlarda, güçlü hücre aracılı bağışıklık reaksiyonu nedeniyle virüs mutasyonuna rağmen hastalık ortaya çıkmaz. Bu, bağışıklık sisteminin enfekte kan hücrelerini kontrol altında tutmasını sağlar. Bu hayvanlar klinik semptomlar olmadan kalır , ancak onu gizli virüs taşıyıcıları olarak salgılamaya devam eder . Bazı hayvanlarda virüsün tamamen ortadan kaldırıldığından şüphelenilir, ancak bu onları tekrar yeni enfeksiyonlara karşı duyarlı hale getirir.
FIP muhtemelen sadece bağışıklık sistemi bozulduğunda klinik olarak kendini gösterir , örn. B. Bağırsakta daha güçlü bir virüs replikasyonuna yol açan stres veya diğer hastalıklar. Antikorların oluşumu , virüsü nötralize edemedikleri için patogenez üzerinde etkilidir . Artan antikor oluşumu ile, virüsün daha da çoğaldığı daha fazla makrofaj aktive olur. Paradoks aslında patojenleri mücadele oluşturulan antikorlar, bir hastalığın şiddetlenmesi yol açtığını ( " antikor bağımlı geliştirme virüsü enfeksiyonu " ) aynı zamanda, insanlarda (örneğin viral hastalıkların gözlenir AİDS , dang humması ). Bununla birlikte, bu antikora bağlı geliştirme muhtemelen sadece deneysel enfeksiyonlarda bir rol oynar.
Geçmişte hastalık iki ana forma (“ıslak” ve “kuru”) ayrıldı. Bununla birlikte, iki ana form arasındaki sınırlar akışkandır, hemen hemen her hasta hayvan, biri geçici olarak baskın olabilen her iki tezahürün bileşenlerini gösterir. Bu nedenle, bu alt bölüm, daha yeni literatürde giderek eskimiş olarak görülmektedir.
"Islak formu"
Zayıf hücre aracılı bir bağışıklık tepkisi durumunda , virüs kanda çoğalmaya ( viremi ) ve yoğun bağışıklık kompleksleri oluşumuna, kompleman sisteminin ve fagositlerin ( makrofajlar ) aktivasyonuna devam eder . Bu , seröz membranların kan damarı iltihabına ( vaskülit ) ve lenfoplazmasellüler perivaskülite ( kan damarlarının lenfositler ve plazma hücreleri ile karakterize edilen iltihaplanma) yol açar, bu da doku yıkımına ( nekroz ) yol açar . Bununla birlikte, bazı yazarlar, değişikliklerin gerçek granülomatöz vaskülit ve perivaskülit, yani fagositlerin baskın olduğu damarların ve çevrelerinin iltihaplanması olduğu görüşündedir . Lymphoplasmacellular sonra perivaskülit geç bir aşamayı temsil ediyor. Makroskopik, enflamasyon, bu odaklar beyazımsı nodüller olarak görünür. İnflamasyon da serum neden olur ve proteinler için kaçış vücut boşlukları içine ve yatakları, fibrin ile iç organlar .
"Kuru form"
"Kuru formda", esas olarak organlarda ortaya çıkan daha büyük düğümler hakimdir. Bunlar, ıslak form gibi vaskülit / perivaskülitten kaynaklanan kaynaşmış iltihap odaklarıdır. Bazen "granülomatöz" değişiklikler olarak adlandırılırlar, ancak bu gerçek bir granülomatöz iltihaplanma değildir . Sıvı çıkışları bu formda bulunmaz. Bu formun daha az ciddi şekilde zayıflamış hücre aracılı bir bağışıklık tepkisi ile geliştiği ve daha hafif, daha uzun süreli bir formu temsil ettiği varsayılmaktadır. FIP vakalarının yaklaşık yüzde 17'sini oluşturur, ancak zor teşhis edilebilirlik nedeniyle (aşağıya bakınız), bildirilmeyen önemli sayıda vaka beklenebilir.
Belirtiler
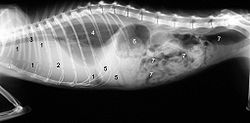
Klinik olarak belirgin FIP, yem tüketiminin azalması ( anoreksi ), zayıflama ve tekrarlayan, tedaviye dirençli ateş ile başlar . Diğer belirtiler ifade şekline bağlı olup, iki form arasında yumuşak geçişler meydana gelebilir. Islak ve kuru formlara bölünme, kesinlikle makroskopik bulguların bir açıklamasıdır. Mikroskobik olarak , her iki form da genellikle aynı bir görüntü oluşturur.
"Islak formu"
Klasik "ıslak form", karın boşluğunda ( asit , asit ) veya göğüs boşluğunda ( plevral efüzyon ) sıvı birikmesinde kendini gösterir . Karın boşluğunda sıvı birikmesi, genellikle klinik olarak dalgalanma ile çevrede bir artış olarak teşhis edilebilir. Göğüs boşluğunda sıvı birikmesi ciddi nefes darlığına neden olabilir. Bir delik sarımsı, lifli, viskoz bir sıvı sağlar. Görünüşünde oldukça tipik olan bunun protein açısından zengin bir eksüda olması , önemli bir tanı kriteridir.
"Kuru form"
"Kuru form", özellikle karın bölgesinde nodüler değişikliklerde kendini gösterir . Beyin , gözler , organları göğüs boşluğunda ya da sadece derinin de etkilenebilir. Organın konumuna bağlı olarak sarılık , göz hastalıkları ( üveit , kornea değişiklikleri ["koyun yağı çökeltileri"], ön kamarada kanama veya fibrin birikimleri , retinit ), anemi veya nörolojik semptomlar (konvülsiyonlar, nöbetler, oryantasyon bozukluğu, göz titremeleri) , felç ) oluşabilir.
Teşhis
Antibiyoza yanıt vermeyen daha genç bir kedide (altı yaşından küçük ) herhangi bir ateşte ilk klinik şüphe verilir .
Vücut boşluklarında yağ birikimler ( “nemli bir şekilde”) ve artmış içeriği globülinleri içinde kan ( hiperglobulinemi ) zaten açık bir endikasyon vardır. Kan sayımındaki belirli değişiklikler (orta ila şiddetli anemi , nötrofili ve lökopeni ) diğer şüpheli faktörlerdir.
FIP tespiti için altın standart , doku makrofajlarında koronavirüsün immünohistokimyasal tespitidir . Diğer tüm prosedürler daha az invazivdir, ancak bazı durumlarda önemli ölçüde daha az bilgilendiricidir. Aşağıdaki laboratuvar teşhis test yöntemleri mümkündür:
- Rivalta numunesi : Bir delinme , etkilenen vücut boşluğundan sıvıyı uzaklaştırır. Bir deney tüpündeki damıtılmış suya bir damla buzlu asetik asit eklenir ve bir damla noktalı madde ilave edilir. FIP ile enfekte olursa, damla çözülmez ve dibe batar. Negatif bir test sonucu neredeyse kesinlikle FIP'yi ( özgüllük yüzde 98) dışlar , pozitif bir test ise bunu olası kılar, ancak kanıtlamaz. Son çalışmalara göre , duyarlılık sadece yüzde 52'dir. Tümörlerin neden olduğu pürülan serozit ve efüzyon durumunda da pozitif bir Rivaltaprobe ortaya çıkabilir . Duyarlılık genç kedilerde daha yüksek, yaşlı hayvanları da incelerseniz yüzde 65,5'e düşüyor.
- Delinmede antikor tespiti : Delinmedeki antikorların antikor boyama yoluyla tespiti , yaklaşık yüzde 85'lik bir duyarlılık ve özgüllüğe sahiptir.
- Makrofajlarda antijen tespiti : Islak formda, ponksiyonun santrifüjünden bir yayma yapılabilir ve bir anti-koronavirüs konjugatı ile karıştırılabilir. Bu tespit yönteminin duyarlılığı, çalışmaya bağlı olarak yüzde 68-95 olarak verilmektedir. Özgüllük, literatürde uzun süredir yüzde 100 olarak verilmiştir, ancak yakın zamanda yapılan bir çalışma, kalp efüzyonu olan kedilerde üç yanlış pozitif sonuç vermiştir (özgüllük yüzde 93).
- Albümin-globülin bölüm : belirlenmesi bölüm arasında albümin ve globulin kandaki konsantrasyonu, aynı zamanda, hastalığın bir gösterge temin edebilecektir. Bölüm 1'den küçükse FIP'den şüphelenilir; 0,6'nın altındaki değerler neredeyse tanısal kabul edilir. Ancak, bölümün boyutuna bağlı olarak duyarlılık ve özgüllük açısından önemli dalgalanmalar vardır. 0.9'luk bir bölümle, duyarlılık yüzde 89 ve özgüllük yüzde 76'dır. Değer 0,6'nın altındaysa, duyarlılık yalnızca yüzde 48, özgüllük yüzde 99'dur.
- Yüksek düzeyde asitli alfa1 glikoprotein , bir akut faz proteini , FIP göstergesidir.
- Kanda antikor tespiti : Kanda pozitif dolaylı antikor tespiti net değildir. Sadece zararsız varyant olsa bile, kedinin koronavirüs ile teması olduğunu söylüyor. Duyarlılık yüzde 85'tir, ancak özgüllük yalnızca yüzde 57'dir. 1: 1600'den az titreye sahip pozitif bir test , özgüllüğü yaklaşık yüzde 98'e yükseltir, ancak duyarlılığı yüzde 33'e düşürür.
- Kanda antijen-antikor kompleksi tespiti: ELISA kullanılarak antijen-antikor komplekslerinin tespiti sadece yaklaşık yüzde 50'lik bir duyarlılığa sahiptir, özgüllük yüzde 91'dir.
- FCoV-RT-PCR : Coronavirüs RNA'sı ve dolayısıyla viremi , bir RT-PCR yöntemi kullanılarak tespit edilebilir . Kan incelenirken duyarlılık yüzde 15 civarında, mononükleer hücreler incelenirken yüzde 29'dur. Özgüllük yüzde 86-100'dür. Viral RNA'nın tespiti, zararsız ve mutasyona uğramış koronavirüsler arasında bir ayrım yapılmasına izin vermez. Buna karşılık, efüzyon sıvısından RT-PCR ile duyarlılık ve özgüllük yüksektir (> yüzde 90). Dışkıda tespit sadece koronavirüs salgılayıcılarını tespit etmek için kullanılır, hastalığın teşhisi için uygun değildir.
Farklı prosedürlerin bir kombinasyonu tanısal önemi artırır. Bir belirleme laktat dehidrojenaz (bir enzim olduğu dönüştürür laktat içine piruvat ) serbest ile hemoliz olabildiğince hastalık ile ilgili daha fazla bilgi sağlayabilir artışının belirlenmesi pankreatik enzimin , alfa-amilaz , genellikle FIP neden olduğu kedilerde, .
Efüzyondaki bir antijen tespitinin kesin olduğu düşünülürken, "kuru formu" tespit etmek zordur. Tespit yöntemleri 4-8 de mümkündür, ancak şimdiye kadar sadece patohistolojik tespit FIP'nin varlığı için kesindir. Formalinle sabitlenmiş dokudaki immünohistokimyasal antijen tespiti, taze dokuya göre daha hassastır. Bu parametrelerde herhangi bir değişiklik olmayan FIP kedileri olduğu gibi, bu parametrelerde belirgin sapmalara rağmen FIP'si olmayan hayvanlar da vardır. Akciğerler , karaciğer , böbrekler ve lenf düğümlerinden alınan doku örneklerinde ( biyoptat ) antikorların tespiti kesin olarak kabul edilir, ancak zararsız FCoV varyantı ve kedilerin maruz kaldığı diğer koronavirüsler ( canine koronavirüs , TGE virüsü) ile çapraz reaksiyonlar vardır. prensipte duyarlıdır, ancak bu FIP'yi tetiklemez. Dokularda bir PCR -Virusnachweis de ticari olarak mevcuttur.
2012'den beri , iki koronavirüs varyantının net bir moleküler biyolojik karakterizasyonunu vaat eden bir tespit yöntemi var . Mutasyona uğramış varyant ve dolayısıyla FIP ile doğrudan ilişkili olan iki sivri proteindeki mutasyonlar, PCR vasıtasıyla tespit edilir. Bu test ayrıca 2013'ten beri ticari olarak mevcuttur ve efüzyon, beyin omurilik sıvısı ve aköz hümör aspiratlarının yanı sıra EDTA kanında da yapılabilir.
Ayırıcı tanı
Oldukça tipik nemli formda, diğer asit ve / veya plevral efüzyon nedenleri ekarte edilmelidir. Bunlara her şeyden önce bir kalp hastalığı , kanda protein eksikliği ( hipoproteinemi ), tümör hastalıklarına bağlı konjestif efüzyonlar , kanama veya bakteriyel plörezi veya peritonit dahildir; daha nadiren streptotrikoz (önceden bir mantar hastalığı olduğu düşünülen pürülan bakteriyel plörezi, ancak buradaki sıvı kahverengimsi- bulutludur ) veya torasik kanalın yırtılması ( şilotoraks ). Bu hastalıkların büyük bir kısmı, bunun neden olduğu efüzyonun ( transüda ) nispeten düşük protein içeriği ve tümör hücrelerinin veya bakterilerin olmaması nedeniyle oldukça kolay bir şekilde dışlanabilir .
Kedi lösemi , kedi bağışıklık yetmezliği sendromu , panleucopenia , limfosarkom , Yersiniosis, ve Tyzzer hastalığı gerektiğini eğer düşünülebilir ateş terapisi ya nodüler değişimlerine karşı dayanıklıdır .
Tedavi ve profilaksi
Klinik olarak kendini gösteren bir FIP genellikle birkaç hafta içinde ölüme yol açar, özellikle "ıslak formu" olan daha genç hayvanlar kısa bir hayatta kalma süresine sahiptir. Ortalama hayatta kalma süresi dokuz gündür, enfekte hayvanların yüzde 95'i bir yıl içinde ölür. Yani her 20 kediden biri bir yıldan fazla yaşayabilir, bu nedenle ötenazi hemen endike değildir.
FIP tedavi edilebilir. Niels C. Pedersen tarafından 2018 yılında yapılan çalışmada, 31 kedi, rhesus maymunlarında Ebola'nın önlenmesinde düşük moleküler ağırlıklı bir antiviral olduğu bulunan GS-5734'ün bir ana nükleositi olan antiviral GS-441524 ile tedavi edildi. Hem doku kültürü hem de fare enfeksiyon modellerinde etkili olduğu kanıtlanmıştır. Bu saha testi, kimyasal olarak daha az karmaşık olan 'GS-441524'ün oldukça etkili olduğunu ve doğal olarak oluşan FIP'li kedilerde umut verici tedavi sonuçları gösterdiğini gösterdi. Bu sonuçlar, 13 Şubat 2019'da Journal of Feline Medicine and Surgery'de (JFMS) yayınlandı.
2016'da yapılan bir çalışmada , viral 3C benzeri proteazın (3CLpro) bir inhibitörü olan GC376 ile bir tedavi, birkaç durumda deneysel olarak da elde edilebilir . Bununla birlikte, bu aktif bileşen henüz genel olarak mevcut değildir, bu nedenle şu anda sadece immünosupresyon ile birlikte semptomatik tedavi mümkündür. İmmünosupresif tedaviye ek olarak gerçekleştirilen kedi interferon tedavisinin sağkalım süresi üzerinde faydalı bir etkisi olabileceğine dair belirtiler 2006 yılında yapılan bir çalışmada doğrulanamamıştır. Yüksek doz glukokortikoidlerle , muhtemelen tromboksan sentaz inhibitörü ozagrel ile kombinasyon halinde bir tedavi girişimi yapılabilir . Sekonder bakteriyel enfeksiyonlara karşı bir antibiyotik endikedir.
Aşılama FIP karşı tartışmalıdır. Buradaki temel sorun, kullanılan suşlarla sistemik olarak uygulanan bir aşının (aşı), aşı virüsü tarafından FIP gelişme riskini taşıması, aşı virüsünün saha virüsü ile karıştırılabilmesi ve enfeksiyon yoğunlaştırıcı antikorların oluşmasıdır. Bu nedenle mevcut aşının amacı, hücresel düzeyde ve virüslerin nazofarenksteki giriş portalı alanında yerel IgA'ya dayalı olarak yerel bir bağışıklık tepkisi oluşturmaktır . Bu nedenle aşı buruna damlatılır. Aşı suşu sadece 31°C sıcaklıkta çoğalabildiği için aşının tek lokal etkisi garanti edilir. Halihazırda FCoV pozitif olan hayvanlarda (ayrıca zararsız varyant nedeniyle), aşılama ilkesi başarısız olur. Bu nedenle sadece sınırlı bir ölçüde tavsiye edilebilir. Büyük sürülerdeki seronegatif kediler için olduğu kadar, büyük "virüs yükü" nedeniyle vücuda giren virüs malzemesiyle (örn. Aşı (koruyucu etkisi Primucell FIP ® ) üretilen çok farklı sonuçlar de klinik çalışmalarda . Çalışmaya bağlı olarak 0 (koruyucu etkisi olmadığı için) ile yüzde 75 arasında bir verim belirtildi.
Virüs girişiminin zararsız ilk varyantının yayılmasını önlemek için , Addie & Jarrett tarafından 1992'de sunulan " Early Weaning'i takip etmek " (İngilizce., Early weaning ) kavramı . Hamile anne kedi iki hafta doğum ve önce diğer kedilerden izole edilmiştir doğum ve genç kedilerin şahlanmaktalar tabi sıkı hijyen koşulları. Yavru kediler beş ila altı haftalık olduklarında sütten kesilir ve annelerinden ayrılırlar çünkü bu noktaya kadar sadece anneden gelen antikorlar tarafından korunurlar ve daha sonra virüsü ondan bulaştırabilirler. Tüm yavru kedilerin daha sonra FCoV-seronegatif olduğu Büyük Britanya'daki başarıların aksine , bu sonuç bir Alman çalışmasında tekrarlanamadı.
Daha uygulanabilir bir strateji, kedi popülasyonundaki enfeksiyon baskısını azaltmaktır . Prensip, potansiyel olarak hastalığa neden olan FCoV virüslerini mümkün olduğunca azaltmaktır ve zaten basit hijyenik yöntemlerle gerçekleştirilebilir. Olası önlemler önerilir:
- Günde birkaç kez temizlenmesi gereken mümkün olduğunca çok dışkı kutusu kurun.
- mümkünse her zaman aynı içme ve besleme kaplarını kullanın ve her gün temizleyin
- Kedileri 3 ila 4 hayvandan oluşan küçük gruplar halinde tutun
- Güçlü virüs kırıcıların gruptan çıkarılması
- Altlıktan 2 hafta önce barajları gruptan çıkarın ve yavruları ayrı olarak büyütün.
Öykü
FIP, 1954'ten itibaren ABD'de artan bir şekilde gözlendi, ancak şüpheli FIP vakalarına ilişkin bireysel raporlar 1914 gibi erken bir tarihte bulunabilir. 1963'te Jean Holzworth ilk kez daha ayrıntılı bir makale yazdı, 1966'da Wolfe ve Griesemer hastalığın bulaşıcı doğasını gösterdi ve daha ayrıntılı bir açıklama yaptı. 1968'de Zook ve ark. Hastalığa deneysel olarak bulaşan kedilerde virüs ilk kez bir elektron mikroskobu kullanılarak tespit edildi. Patojenin bir koronavirüs olduğundan 1970'den beri şüpheleniliyordu, ancak patojenin tespit edilmesi 1976'ya kadar değildi ( Osterhaus ve ark. ) Ve bir hücre kültüründe üremesi ( Pedersen ). 1977'den itibaren patojene başlangıçta "FIP virüsü" (FIPV) adı verildi. 1979'da antikorların tespiti için ilk ELISA testi geliştirildi. 1981 yılında Pedersen ve ark. ilk kez kedi enteral koronavirüsünün (FECV) yaygın bir şekilde ortaya çıkması ve FIPV ile büyük benzerlik gösterdi. 1987'de Pedersen , FECV ve FIPV'nin ortak bir virüs spektrumunu temsil ettiğini ve sadece virülansları açısından farklılık gösterdiğini varsaymıştır. 1998'de çalışma grubu ( Vennema ve diğerleri ) FIPV'nin sadece FECV'nin bir mutasyonu olduğunu kanıtlamayı başardı. 2000 yılından itibaren, Felines Coronavirus (FCoV) terimi patojenin adı oldu.
Aşı geliştirmeye yönelik ilk deneysel girişimler 1980'lerin başlarına kadar gitmektedir. Farklı aşı suşları ile yapılan deneyler ( heterolog virüs, 1979, 1984,1988; homolog öldürücü virüsü, 1983; homolog zayıflatılmış virüs, 1983; aşı virüsü - rekombinantlar , 1992 1990) herhangi bir saptanabilir koruyucu etkiyi ve hatta aşılama hastalıklara yol vermedi bazıları Anlamda, antikora bağlı bir bağışıklık geliştirmesi (aşağıya bakınız) tezahür etti. İlk güvenli ticari aşı 1991 yılında Pfizer tarafından üretilmiştir.
Şiddetli Akut Solunum Sendromu'nun (SARS) ortaya çıkması ve 2003 yılında patojenin bir koronavirüs olduğunun keşfedilmesiyle, insanlarda bu ciddi solunum hastalığından FCoV ve diğer hayvan koronavirüslerinin sorumlu olduğundan şüphelenildi. FCoV, nükleotid diziliminde SARS virüsüne büyük benzerlikler gösterir. Ancak, bu varsayımlar doğrulanmadı.
Edebiyat
- DD Addie, JO Jarrett: Yavru kedilerde doğal olarak oluşan kedi koronavirüs enfeksiyonları üzerine bir çalışma. İçinde: Veteriner Kaydı. Cilt 130, 1992, ISSN 0042-4900 , sayfa 133-137 , doi: 10.1136 / vr.130.7.133 .
- Christina Binder: Kedi enfeksiyöz peritonit tanısı için farklı parametrelerin karşılaştırılması. Münih 2001 (Münih, üniversite, tez, 2001).
- Yvonne Fischer: Kedi enfeksiyöz peritonitinin tanı ve tedavisi üzerine çalışmalar. Münih LMU Veteriner Fakültesi'nde Tez , 2012 ( PDF; 4.7 MB )
- Katrin Hartmann: Kedi enfeksiyöz peritoniti. İçinde: Kuzey Amerika Veteriner Klinikleri. Küçük Hayvan Uygulaması. Cilt 35, No. 1, 2005, ISSN 0195-5616 , sayfa 39-79 , doi: 10.1016 / j.cvsm.2004.10.011 .
- Katrin Hartmann: Kedi enfeksiyöz peritonit - tanı, tedavi ve profilaksi. İçinde: Küçük Hayvan Uygulaması. Cilt 55, 2010, ISSN 1434-9132 , s. 561-572.
- Niels C. Pedersen: Kedi enfeksiyöz peritonit virüsü enfeksiyonunun virolojik ve immünolojik yönleri. İçinde: Deneysel Tıp ve Biyolojideki Gelişmeler. Cilt 218, 1987, ISSN 0065-2598 , sayfa 529-550, doi : 10.1007/978-1-4684-1280-2_69 .
- Friederike Riemer: Kedi enfeksiyöz peritonitli kedilerde klinik semptomlar ve laboratuvar parametre değişiklikleri. LMU Münih Veteriner Fakültesi'nde Tez , 2018 ( PDF; 3.8 MB )
- Harry Vennema, Amy Polonya, Janet Foley, Niels C. Pedersen: Kedi enfeksiyöz peritonit virüsleri, endemik kedi enterik koronavirüslerinden mutasyonla ortaya çıkar. İçinde: Viroloji. Cilt 30, No. 1, 1998, sayfa 150-157, doi: 10.1006 / viro.1998.9045 .
İnternet linkleri
Bireysel kanıt
- ^ MA Kennedy: Feline Enfeksiyöz Peritonit: Patogenez, Teşhis ve Tedaviye İlişkin Güncelleme. İçinde: Kuzey Amerika'nın Veteriner klinikleri. Küçük hayvan alıştırması. Cilt 50, sayı 5, Eylül 2020, s. 1001-1011, doi : 10.1016 / j.cvsm.2020.05.002 , PMID 32563530 (inceleme).
- ↑ Robert Hertzsch ve Angelika Fischer: FIP tedavisi için GS-441524 şu anda yasal değil! İçinde: Dt. TÄBl. Cilt 69, sayı 7, sayfa 810.
- ↑ Wilfried Kraft, Ulrich M. Dürr: Kedi hastalıkları . Ed.: W. Kraft. 4. baskı. M & H Schaper, Hannover 1996, ISBN 3-7944-0178-6 , s. 138 .
- ↑ a b c d e Susanne Held, Reto Neiger: Kedi enfeksiyöz peritonitinin (FIP) etiyolojisi, epidemiyolojisi ve teşhisi. İçinde: Küçük Hayvan Uygulaması . Cilt 58, 2013, s. 80-96.
- ↑ a b c d Jürgen Kremendahl: Kedilerde bulaşıcı peritonit - güncel bir bakış. In: özellikle küçük hayvan. Cilt 17, Sayı 2, 2014, sayfa 10-14, doi: 10.1055 / s-0033-1361536
- ↑ A. Kipar, H. May, S. Menger, M. Weber, W. Leukert, M. Reinacher: Morfolojik Özellikler ve Granülomatöz Vaskülitin Feline Enfeksiyöz Peritonitinde Gelişimi. İçinde: Veteriner Patolojisi. Cilt 42, No. 3, 2005, ISSN 0300-9858 , sayfa 321-330. PMID 15872378 , doi: 10.1354 / vp.42-3-321 .
- ^ Y. Fischer, C. Sauter-Louis, K. Hartmann: Kedi enfeksiyöz peritoniti için Rivalta testinin tanısal doğruluğu. İçinde: Veteriner klinik patolojisi / Amerikan Veteriner Klinik Patoloji Derneği. Cilt 41, Sayı 4, Aralık 2012, s. 558-567, doi: 10.1111 / j.1939-165X.2012.00464.x , PMID 22913882 .
- ↑ Katrin Hartmann ve ark.: Kedi enfeksiyöz peritonitini teşhis etmek için farklı testlerin karşılaştırılması. İçinde: Veteriner Dahiliye Dergisi. Cilt 17, sayı 6, 2003 Kasım-Aralık, s. 781-790, doi : 10.1111 / j.1939-1676.2003.tb02515.x , PMID 14658713 , PMC 7197515 (serbest tam metin).
- ↑ Susanne Held: Vücut boşluğu efüzyonu olan kedilerde Kedi Enfeksiyöz Peritonit (FIP) Tanı Testlerinin Doğruluğu. Veterinerlik tezi Giessen 2013; Alman Veteriner Tıp Derneği, Giessen 2014, ISBN 978-3-86345-201-8 . ( Dijitalleştirilmiş sürüm ).
- ^ SJ Doenges, K. Weber, R. Dorsch, R. Fux, K. Hartmann: Periferik kan mononükleer hücrelerinin gerçek zamanlı ters transkriptaz polimeraz zincir reaksiyonunun karşılaştırılması, kedi enfeksiyonu teşhisi için serum ve hücresiz vücut boşluğu efüzyonu peritonit. İçinde: Kedi tıbbı ve cerrahisi dergisi. Cilt 19, Sayı 4, Nisan 2017, sayfa 344-350, doi: 10.1177 / 1098612X15625354 , PMID 26787293 .
- ^ DR Rissi: Doğal olarak oluşan kedi enfeksiyöz peritonitinin nöropatolojisi ve teşhisi üzerine retrospektif bir çalışma. İçinde: Veterinerlik tanı araştırması dergisi: Amerikan Veteriner Laboratuvarı Teşhis Uzmanları Derneği'nin resmi yayını, Inc. Cilt 30, Sayı 3, Mayıs 2018, pp. 392-399, doi: 10.1177 / 1040638718755833 , PMID 29411701 .
- ↑ Hui-Wen Chang, Herman F. Egberink, Rebecca Halpin, David J. Spiro, Peter JM Rottier: Spike protein füzyon peptidi ve kedi koronavirüs virülansı. İçinde: Gelişen Bulaşıcı Hastalıklar . Cilt 18, Sayı 7, Temmuz 2012, ISSN 1080-6059 , s. 1089-1095 , doi: 10.3201 / eid1807.120143 , PMID 22709821 , PMC 3376813 (serbest tam metin).
- ↑ Deutsches Tierärzteblatt. Cilt 61, 2013, sayfa 281.
- ↑ Joachim Frey : Solunum organlarının hastalıkları. İçinde: Ludwig Heilmeyer (ed.): Dahiliye ders kitabı. Springer-Verlag, Berlin / Göttingen / Heidelberg 1955; 2. baskı aynı eser 1961, sayfa 599-746, burada: sayfa 694 ( streptotrikoz ).
- ↑ Marian C. Horzinek : Feline Enfeksiyöz Peritonit (FIP) kontrol altına alınabilir mi? İçinde: Kleintiermedizin No. 5, 2016, s. 210–217.
- ↑ Pedersen NC, Perron M, Bannasch M, ve diğerleri: Doğal olarak oluşan kedi enfeksiyöz peritoniti olan kedilerin tedavisi için nükleozid analogu GS-441524'ün etkinliği ve güvenliği. İçinde: J Feline Med Surg. Cilt 21, Sayı 4, 2019, sayfa 271-281. doi: 10.1177 / 1098612X19825701
- ↑ Kim Yunjeong ve diğerleri: Kedilerde Ölümcül Coronavirüs Enfeksiyonunun İlerlemesinin Geniş Spektrumlu Coronavirüs Proteaz İnhibitörü Tarafından Tersine Çevirilmesi . In: PLOS patojenleri 2016, doi: 10.1371 /journal.ppat.1005531
- ↑ Susanne Ritz, Herman Egberink, Katrin Hartmann: Feline Interferon-Omega'nın Feline Enfeksiyöz Peritonitli Kedilerin Hayatta Kalma Süresi ve Yaşam Kalitesi Üzerindeki Etkisi. İçinde: Veteriner Dahiliye Dergisi. Cilt 21, No. 6, 2006, ISSN 0891-6640 , s. 1193-1197, doi: 10.1111 / j.1939-1676.2007.tb01937.x .
- ↑ DD Addie, JO Jarrett: Yavru kedilerde doğal olarak oluşan kedi koronavirüs enfeksiyonları üzerine bir çalışma. İçinde: Veteriner Kaydı. Cilt 130, 1992, sayfa 133-137 , doi: 10.1136 / vr.130.7.133 .
- ^ John Stavrinides, David S. Guttman: Şiddetli akut solunum sendromu koronavirüsünün mozaik evrimi. İçinde: Viroloji Dergisi. Cilt 78, No. 1, 2004, ISSN 0022-538X , sayfa 76-82. PMID 14671089 , doi: 10.1128 / JVI.78.1.76-82.2004 .








