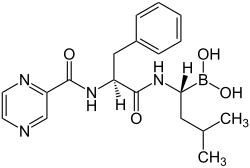
Bortezomib
| Yapısal formül | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Genel | ||||||||||||||||||||||
| Tescilli olmayan isim | Bortezomib | |||||||||||||||||||||
| diğer isimler |
|
|||||||||||||||||||||
| Moleküler formül | C 19 H 25 BN 4 O 4 | |||||||||||||||||||||
| Harici tanımlayıcılar / veritabanları | ||||||||||||||||||||||
| ||||||||||||||||||||||
| İlaç bilgisi | ||||||||||||||||||||||
| ATC kodu | ||||||||||||||||||||||
| İlaç sınıfı |
Proteazom inhibitörü |
|||||||||||||||||||||
| özellikleri | ||||||||||||||||||||||
| Molar kütle | 384,24 g mol −1 | |||||||||||||||||||||
| güvenlik talimatları | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Mümkün olduğunca ve geleneksel olarak, SI birimleri kullanılır. Aksi belirtilmedikçe, verilen veriler standart koşullar için geçerlidir . | ||||||||||||||||||||||
Bortezomib'in bir olan ilaç olmuştur onaylanan için tedavi ait multipl miyelom (plazmasitom) . Bortezomib'in yeni bir sınıfta ilk proteazom - inhibitörleri ve altında enjeksiyon terkibinde markası Velcade'ın tarafından ABD'de Milenyum İlaç , bir yan kuruluşu arasında Takeda İlaç tarafından ve Almanya'da Janssen-Cilag , bir yan kuruluşu Johnson & Johnson pazarladı.
gösterge
AB'de bortezomib, daha önce en az bir tedavi görmüş ve kemik iliği nakli geçirmiş veya kemik iliği nakli için uygun olmayan hastalarda ilerleyici multipl miyelom tedavisi için 26 Nisan 2004 tarihinden beri monoterapi olarak onaylanmıştır. .
28 Ağustos 2008'den beri, bortezomib, kemik iliği transplantasyonu ile yüksek doz kemoterapi için uygun olmayan, önceden tedavi edilmemiş multipl miyelomlu yetişkin hastaların tedavisi için melfalan ve prednizon ile kombinasyon halinde onaylanmıştır .
Bortezomib, bugüne kadar tedavi edilmemiş multipl miyelomu tedavi etmek için başka ilaçlarla birlikte de kullanılabilir. 2019'da Piechotta ve ark. Yeni tanı konmuş ve tedavi edilmemiş multipl miyelomlu yetişkinler için çoklu ilaç kombinasyonlarının güvenliğini ve etkinliğini karşılaştırmak için randomize kontrollü çalışmaların bir ağ meta-analizini kullanarak bir Cochrane incelemesi gerçekleştirdi. Çalışma katılımcılarının 65 yaşından büyük olması veya kök hücre nakli için uygun olmaması veya 18 ila 65 yaşları arasındaysa yüksek dozda tedavi olması gerekiyordu. Bortezomib aşağıdaki kombinasyonlarda değerlendirildi: bortezomib artı melfalan ve prednizon ve ardışık olarak bortezomib artı lenalidomid artı deksametazon . Mümkün olduğunda, bu kombinasyonlar medyan risk tedavisini temsil ettiğinden, bu kombinasyonlar melfalan artı prednizon ile karşılaştırıldı. Sonuçlar aşağıdaki gibidir: Sürekli bortezomib artı lenalidomid artı deksametazon uygulamasının genel sağkalımda bir artışa neden olması muhtemeldir. Bortezomib artı melphalan ve prednizon, genel sağkalımda büyük bir artışa neden olabilir. Bortezomib artı melphalan ve prednizon ve bortezomib artı lenalidomid artı deksametazonun sürekli uygulanması, progresyonsuz sağkalımda büyük bir artışa neden olabilir. Bortezomib artı melphalan ve prednizon muhtemelen polinöropati riskinde belirgin bir artışa neden olur. Diğer ilaç burada karşılaştırılmadı. Bortezomib artı melphalan ve prednizon uygulamasının ciddi advers olaylarda artışa neden olması muhtemeldir. Diğer ilaç burada karşılaştırılmadı. Devam eden bortezomib artı lenalidomid artı deksametazon uygulaması, advers olaylar nedeniyle hastanın tedavisinin kesilmesinde belirgin bir artışa neden olmuştur. Bortezomib artı melphalan ve prednizon uygulaması, advers olaylar nedeniyle hasta bırakmalarında muhtemelen küçük bir artışa neden olmuştur.
Bortezomib, diğer hematolojik kanserler ve katı tümörler gibi diğer endikasyonlar için klinik deneylerde test edilmektedir . Aynı zamanda kolon , akciğer , pankreas , meme , prostat ve yumurtalık kanseri ve Hodgkin dışı lenfomalara karşı etkinliği test edilmektedir. Bu madde ayrıca anti-NMDA reseptör ensefalitinin deneysel tedavisinde de kullanılmaktadır .
Uygulama ve dozaj
Aktif bileşen a, dondurularak kurutulmuş bir şeklinde toz manitol ester ile boronik asit grubu ve gereken çözülmüş olarak tuzlu su , enjeksiyon amaçları için uygulamadan önce . Mannitol ester hazırlandıktan sonra hidroliz ürünü ile denge halindedir .
Bortezomib intravenöz veya subkutan olarak enjekte edilir , önerilen doz m 2 vücut yüzeyi başına 1.3 mg'dır . Önleyici bir önlem olarak, bulantı önleyici bir madde verilebilir ve ardından salin solüsyonu (yaklaşık 50 ml) ile durulanabilir. Her enjeksiyondan önce kan sayımının kontrol edilmesi önerilir. Örneğin trombosit sayısı , lökosit sayısı ve hemoglobin değeri izlenmelidir. Her üç değer de tedavi sırasında düşebilir. Tedavi süresi, hastalığın cevabına bağlıdır; genellikle 8'den fazla döngü verilmez. SUMMIT çalışmasında hastalıkla ilerlemeyen ve ciddi yan etkisi olmayan tüm hastalar 8 kür ile tedavi edildi.
Hareket mekanizması
Proteazomlar , hücre döngüsünü ve dolayısıyla hücre büyümesini düzenleyen proteinlerin parçalanmasında önemli bir rol oynar . Bortezomib , kontrolsüz büyüme ile karakterize edilen kanser hücrelerinin metabolik yollarını bloke ederek çalışır . Bir proteazom tıkanıklığı meydana gelirse, hayati proteoliz süreçleri baskılanır.
Sonuç olarak, kanser hücresindeki birçok sinyal birbirini iptal eder veya engellenir. Sonuç olarak, bu yol açar
- Tümör büyümesinin engellenmesi
- Anjiyogenezin engellenmesi ( tümörü beslemek için yeni kan damarlarının oluşumu)
- Kanser hücrelerinin apoptozu ( önceden "ölümsüz" kanser hücrelerinin programlanmış hücre ölümü)
- Kemik iliğinin bağ dokusu hücreleri ile etkileşimin engellenmesi.
Sağlıklı hücreler de terapiden etkilenir. Bununla birlikte, bu hücrelerin - kanser hücrelerinin aksine - tedaviye 1, 4, 8 ve 11. günlerde 4 enjeksiyondan sonra on gün süreyle ara verilirse yeniden ürettikleri bulundu. Açıktır ki, kanser hücreleri özellikle proteazomların işlevine bağlıdır ve bu nedenle inhibisyonlarına normal hücrelere göre daha duyarlıdır. Bortezomibin bor atomu , 26S proteazomunun katalitik fonksiyonuna bir ligand olarak yüksek afinite ve seçicilikle bağlanır .
26S proteazomunun katalitik sahasına oldukça spesifik ve yüksek afiniteli bir bağlanma, bu şekilde inhibe edilen bor aracılığıyla gerçekleşir .
Multipl miyelom (plazmasitom) şimdiye kadar tedavi edilebilir, ancak tedavi edilemez olarak kabul edildi. Bortezomib de hiçbir şeyi iyileştiremez, ancak en az bir tedaviyi zaten başarısız olan hastalar için başka bir alternatiftir.
metabolizma
Tek bir intravenöz dozdan sonra, bortezomib plazma konsantrasyonları bifazik azalır. Düşüş, hızlı bir dağıtım fazı ve ardından daha yavaş bir terminal eliminasyon fazı ile karakterize edilir. İnsanlarda yarı ömür 5 ila 15 saat olarak tahmin edilmektedir. In vitro , sitokrom enzimleri CYP3A4 ve CYP2C19, ana metabolik enzimler olarak tanımlanmıştır. Metabolize olmayan ana maddenin sadece küçük bir kısmı idrarda tespit edilirken safra veya dışkıda bozulmamış bortezomib bulunmamıştır .
Yan etkiler
Bortezomib ile tedaviyi de esasen sınırlandıran en önemli yan etki , özellikle ellerde veya ayaklarda ağrı ve uyuşukluğun eşlik ettiği bir sinir bozukluğu olan periferik nöropatidir . Bu yan etkinin terapötik olarak etkilenmesi zordur ve hastayı ciddi şekilde etkileyebilir. Literatüre göre, hastaların% 70 kadarı bundan etkilenir ve ifade şiddetli ila çok şiddetli olabilir (WHO'ya göre derece III-IV) ve hastanın tamamen hareketsizliğine yol açabilir. Bu durumlarda hastanın yaşam kalitesi çok önemlidir ve aylarca kısıtlıdır. Kural olarak nöropati geriler, ancak çok uzun sürebilir.
Bir çalışma, periferik nöropatinin , bortezomib intravenöz yerine subkutan olarak uygulandığında önemli ölçüde daha az görüldüğünü göstermiştir , bu nedenle bu uygulama şekli Eylül 2012'de AB Komisyonu tarafından onaylanmıştır.
Düşük kan hücresi sayısı (yukarıya bakın), mide bulantısı , ishal ve yorgunluk (şiddetli yorgunluk) gibi diğer yan etkiler ortaya çıkabilir.
Tedavi maliyetleri
In İngiltere'de bortezomib tedavisi bir maliyeti vardır £ 18,000 yılda hasta başına. Klinik çalışmalardaki ilacın ömrünü birkaç ay uzatmasına rağmen, İngiliz Ulusal Sağlık Servisi (NHS) ilk taslakta maliyetleri karşılamayı reddetti. Sağlık ve Klinik Mükemmellik Enstitüsü Ulusal (GÜZEL) değerlendirmeleri yeni tedavilerin maliyet etkinliğini için NHS . Bir kıyas ölçütü, iyi bir yaşam kalitesinde ( kaliteye göre ayarlanmış yaşam yılları , QALY) bir yıl yaşam kazanmak için harcanması gereken maliyetlerdir . Genellikle QALY başına £ 30.000'den az bir değer gereklidir.
Üretici ile birkaç ay süren görüşmelerden sonra, NHS 2007 yılında aşağıdaki sözü verdi: Üreticinin önerisi üzerine, bortezomib endike olan tüm hastalar ilacı başlangıçta maksimum dört döngü almalıdır. Bu süre içinde multipl miyelom remisyonu elde edilirse , NHS pahasına tedaviye devam edilecektir. Remisyon sağlanamazsa, tedavi kesilir ve NHS kullanılan ilaçlar için ödeme yapmak zorunda değildir.
Aslında bu, NHS'nin yalnızca ilacın işe yaradığı durumlarda tedavi için ödeme yapması gerektiği anlamına gelir.
Ticari isimler
Bortezomib, Velcade adı altında Almanya, Avusturya ve İsviçre'de ticari olarak mevcuttur.
Edebiyat
- PG Richardson ve diğerleri: Bortezomib veya Relapsed Multiple Myeloma için Yüksek Doz Deksametazon. İçinde: NEJM . 352, 2005, s. 2546-2549. PMID 15958804
- PG Richardson ve diğerleri: Bortezomib multipl miyelomun birinci basamak tedavisinde. İçinde: Uzman Rev Antikanser Ther . 8, 2008, s. 1053-1072. PMID 18588451
- PG Richardson ve diğerleri: Nükseden multipl miyelomda bir faz 3 denemesinin uzatılmış takibi: APEX denemesinin olaya kadar geçen nihai zaman sonuçları. İçinde: Kan . 110 (10), 15 Kasım 2007, s. 3557-3560. Epub 2007 Ağustos 9. PMID 17690257
- JF San Miguel ve diğerleri: Bortezomib artı melfalan ve multipl miyelomun ilk tedavisi için prednizon. İçinde: N Engl J Med . 359 (9), 28 Ağustos 2008, s. 906-917. doi: 10.1056 / NEJMoa0801479 . PMID 18753647
- JF San Miguel ve ark.: Daha önce tedavi edilmemiş multipl miyelomlu hastalarda bortezomib-melfalan-prednizona karşı melfalan-prednizon ile kalıcı genel sağkalım yararı ve ikinci malignite riskinde artış yok. In: Klinik Onkoloji Dergisi . Cilt 31, sayı 4, Şubat 2013, sayfa 448-455, doi : 10.1200 / JCO.2012.41.6180 , PMID 23233713 .
İnternet linkleri
Bireysel kanıt
- ↑ Bu madde için henüz uyumlaştırılmış bir sınıflandırma yoktur . Ne yeniden üretilir bir etiketi olan , (1, 3,5 - ((2S, 2'S, 2 'S) - - (((1 R, 1' R, 1''R), N, N 'N'' 2,4,6-trioksatriborinan-2,4,6-triil) tris (3-metilbütan-1,1-diil)) tris (azandiil)) tris (1-okso-3-fenilpropan-2,1-diyl) ) tris (pirazin-2-karboksamid) içinde sınıflandırılması ve etiketleme envanterine Avrupa Kimyasallar Ajansı (AKA), 28 Aralık 2019 tarihinde erişilebilir.
- ↑ a b c d myelom.at: Velcade® - aktif bileşen bortezomib. ( İnternet Arşivinde 8 Ağustos 2007 Memento ) 27 Haziran 2007'de erişildi.
- ↑ Medknowledge.de: Bortezomib (Velcade®) multipl miyelom (plazmasitom) için onaylandı. ( Memento bölgesinin içinde 5 Eylül 2007 , Internet Archive ) Alınan 27 Haziran 2007.
- ↑ Velcade / Bortezomib (PDF; 89 kB). EMA (CHMP) EPAR Summary for the Public, erişim tarihi 20 Şubat 2013.
- ↑ ema.europa.eu: Velcade® - aktif bileşen bortezomib. (PDF; 173 kB). Erişim tarihi: 3 Ocak 2013.
- ↑ Vanessa Piechotta, Tina Jakob, Peter Langer, Ina Monsef, Christof Scheid: Transplant uygun olmayan multipl miyelomlu yetişkinlerde birinci basamak tedavi için bortezomib, lenalidomid ve talidomidin çoklu ilaç kombinasyonları: bir ağ meta analizi . In: Sistematik İncelemelerin Cochrane Veritabanı . 25 Kasım 2019, doi : 10.1002 / 14651858.CD013487 ( wiley.com [16 Temmuz 2020'de erişildi]).
- ↑ a b ÖAZ akımı: Bortezomib. ( Memento arasında Şubat 20, 2007 , Internet Archive ) Alınan 27 Haziran 2007.
- ↑ a b Yeni İlaçlar - Bortezomib. İçinde: İlaç gazetesi. Erişim tarihi: June 27, 2007.
- ↑ P. Bonvini, E. Zorzi, G. Basso, A. Rosolen: Bortezomib aracılı 26S proteazom inhibisyonu, hücre döngüsü durmasına neden olur ve CD-30 + anaplastik büyük hücreli lenfoma Lösemi 2007, Cilt 21, Sayı 4, sayfalar 838-42, PMID 17268529 , doi: 10.1038 / sj.leu.2404528 .
- ^ PG Richardson, H. Briemberg, S. Jagannath, PY Wen, B. Barlogie, J. Berenson, S. Singhal, DS Siegel, D. Irwin, M. Schuster, G. Srkalovic, R. Alexanian, SV Rajkumar, S Limentani, M. Alsina, RZ Orlowski, K. Najarian, D. Esseltine, KC Anderson, AA Amato: Bortezomib ile İleri Multipl Miyelom Tedavisi Sırasında Periferal Nöropatinin Frekansı, Özellikleri ve Geri Döndürülebilirliği. In: Klinik Onkoloji Dergisi . 24, 2006, sayfa 3113-3120, PMID 16754936 .
- ↑ P. Moreau, H. Pylypenko, S. Grosicki, I. Karamanesht, X. Leleu, M. Grishunina, G. Rekhtman, Z. Masliak, T. Robak, A. Shubina, B. Arnulf, M. Kropff, J Cavet, DL Esseltine, H. Feng, S. Girgis, H. van de Velde, W. Deraedt, JL Harousseau: Nükseden multipl miyelomlu hastalarda bortezomibin subkutan ve intravenöz uygulaması: randomize, faz 3, aşağılık olmayan bir çalışma. İçinde: Lancet Oncol. 12 (5), 2011, sayfa 431-440, doi: 10.1016 / S1470-2045 (11) 70081-X , PMID 21507715 .
- ↑ GÜZEL: Kanser ilaçları sadece işe yaradığında ödenmelidir. ( İnternet Arşivinde 17 Mart 2016 tarihli orijinalin hatırası ) Bilgi: Arşiv bağlantısı otomatik olarak eklendi ve henüz kontrol edilmedi. Lütfen orijinal ve arşiv bağlantısını talimatlara göre kontrol edin ve ardından bu uyarıyı kaldırın. In: aerzteblatt.de , 5 Haziran 2007, 7 Mayıs 2010'da erişildi.
