aseton
| Yapısal formül | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| Genel | |||||||||||||||||||
| Soyadı | aseton | ||||||||||||||||||
| diğer isimler | |||||||||||||||||||
| Moleküler formül | Cı- 3 , H 6 O | ||||||||||||||||||
| Kısa açıklama |
tatlı bir kokuya sahip renksiz sıvı |
||||||||||||||||||
| Harici tanımlayıcılar / veritabanları | |||||||||||||||||||
| |||||||||||||||||||
| özellikleri | |||||||||||||||||||
| Molar kütle | 58.08 g mol -1 | ||||||||||||||||||
| Fiziksel durum |
sıvı |
||||||||||||||||||
| yoğunluk |
0,79 g cm -3 (20 °C) |
||||||||||||||||||
| Erime noktası |
−95 ° C |
||||||||||||||||||
| kaynama noktası |
56 ° C |
||||||||||||||||||
| Buhar basıncı |
|
||||||||||||||||||
| çözünürlük |
su ve birçok organik çözücü ile karışabilir |
||||||||||||||||||
| dipol momenti | |||||||||||||||||||
| Kırılma indisi |
1.3588 (20°C) |
||||||||||||||||||
| güvenlik talimatları | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
DFG / İsviçre: 500 ml m -3 veya 1200 mg m -3 |
||||||||||||||||||
| toksikolojik veriler | |||||||||||||||||||
| Olabildiğince ve alışılageldiği kadarıyla SI birimleri kullanılır. Aksi belirtilmedikçe, verilen veriler standart koşullar için geçerlidir . Kırılma indisi: Na-D çizgisi , 20°C | |||||||||||||||||||
Aseton ya da aseton [ at͡sətoːn ] ortak bir isim için organik kimyasal bileşik propanon ya da dimetil keton . Aseton renksiz bir sıvıdır ve polar aprotik çözücü olarak ve organik kimyada birçok sentez için başlangıç malzemesi olarak kullanılır . İki metil grubu taşıyan karbonil grubunun (>C=O) yapısal özelliği ile en basit ketondur .
Çıkarma ve sunum
Aseton ilk olarak 1606'da Andreas Libavius tarafından kurşun (II) asetatı ısıtarak üretildi . 1661'de Robert Boyle , ahşabın kuru damıtılmasıyla kazanmayı başardı . İlk olarak 1610 yılında Jean Beguin tarafından Tyrocinium Chymicum'da tanımlanmıştır . 20. yüzyılın ortalarına kadar, Chaim Weizmann tarafından keşfedilen ve patenti alınan aseton-bütanol-etanol fermantasyonu, aseton üretimi için de önemli bir süreçti. Anaerobik bakteri Clostridium acetobutylicum endüstriyel üretim için kullanıldı.
Asetonun günümüzde en önemli üretim süreci , Hock fenol sentezi olarak da bilinen kümen hidroperoksit işlemidir :
Burada benzen ve propen önce asit içinde Friedel-Crafts alkilasyonu ile izopropilbenzene ( kümen ) dönüştürülür . Bu, daha sonra ile reaksiyona oksijen , bir de radikal reaksiyon oluşturmak üzere hidroperoksit , parçalanır için fenol ve aseton asidik işlem sırasında .
Başka bir üretim prosesi, izopropanolün dehidrojenasyonu veya oksidehidrojenasyonudur .
Aseton üretmenin başka bir yolu, kalsiyum asetatı ( 1 ) ısıtmaktır, burada aseton ( 2 ) ve kalsiyum okside ("kireç tuzu damıtması") ayrılır .
Bu süreç, 1606'da Libavius'un yukarıda bahsedilen tarihsel sentezine kadar uzanır.
özellikleri
Aseton, karakteristik, hafif tatlı bir kokuya sahip, renksiz, düşük viskoziteli , son derece yanıcı ve hava ile patlayıcı bir karışım oluşturan bir sıvıdır. Normal basınçta kaynama noktası 56 ° C'dir. Su ve çoğu organik çözücü ile her oranda karışabilir. Aseton molekülü keto-enol tautomerizmi gösterir ; Bunu pKa s değeri 20 aseton kutupsal bağlı olabilir bir karbonil grubu katyonlar da kompleks bileşikler oluşturmak ile.
Bileşik, bir dizi başka çözücü ile azeotropik karışımlar oluşturur . Azeotropik bileşimler ve kaynama noktaları aşağıdaki tabloda bulunabilir. Su , etanol , 1-propanol , 2-propanol , n-butanol , benzen , toluen , etilbenzen , dietil eter , etil asetat ve asetonitril ile azeotroplar oluşturulmaz .
| Çeşitli çözücülerle azeotroplar | ||||||||||||
| çözücü | n -pentan | n -heksan | n -heptan | sikloheksan | Metanol | kloroform | Karbon tetraklorür | diizopropil eter | metil asetat | |||
| aseton içeriği | içinde% | 21 | 59 | 90 | 67 | 88 | 22. | 89 | 61 | 50 | ||
| kaynama noktası | °C cinsinden | 32 | 50 | 56 | 53 | 55 | 64 | 56 | 54 | 55 | ||
termodinamik özellikler
Antoine'a göre , buhar basıncı fonksiyonu log 10 (P) = A− (B / (T + C)) (P bar olarak, T cinsinden K) ile A = 4.42448, B = 1312.253 ve C = −32.445 in sıcaklık aralığı 259.2 ila 507.6 K.
| Emlak | Tür | Değer [birim] | Uyarılar |
|---|---|---|---|
| Standart oluşum entalpisi | Δ f H 0 sıvı Δ f H 0 gaz |
-249,4 kJ mol -1 -218,5 kJ mol -1 |
sıvı olarak gaz olarak |
| yanma entalpisi | Δ c H 0 gaz | -1821.4 kJ mol -1 | |
| Isı kapasitesi | c s | 125,45 J mol −1 K −1 (25 °C) 2,16 J g −1 K −1 (25 °C) 75,02 J mol −1 K −1 (25 °C ) 1,29 J g −1 K −1 (25 ° C) |
sıvı olarak gaz olarak |
| Kritik sıcaklık | T c | 508.15K | |
| kritik basınç | p c | 47.582 bar | |
| kritik yoğunluk | ρ c | 4.63 mol·l -1 | |
| asentrik faktör | ω c | 0.30653 | |
| füzyon entalpisi | Δ f H | 5,72 kJ mol -1 | erime noktasında |
| buharlaşma entalpisi | Δ V H | 29,1 kJ mol -1 | normal basınç kaynama noktasında |
Buharlaşma entalpisinin sıcaklığa bağımlılığı Δ V H 0 = A e (−βT r ) (1 − T r ) β (Δ V H 0 cinsinden kJ / mol, T r = (T / T / T c A) düşük sıcaklık) = 46.95 kJ / mol, β = 0,2826 ve T, c 298 K sıcaklıkta ve 363 K arasında bir sıcaklık aralığında = 508.2 K Spesifik ısı kapasitesi C ile 5 ° C ve 50 arasında bir sıcaklık aralığında ° C ile doğrusal bir fonksiyonu olarak hesaplanabilir p = 1.337 + 2,7752 · 10 -3 · S (C ile p kJ-kg -1 .K -1 ve T cinsinden K) tahmin edilebilir.
Buhar basıncı -Asetonun işlevi
Sıcaklık bağımlılığı buharlaşma ısısı aseton
Spesifik ısı kapasitesi aseton
Güvenlikle ilgili parametreler
Aseton, son derece yanıcı buhar-hava karışımları oluşturur. Bileşik -20 ° C'nin altında bir parlama noktasına sahiptir . Patlama aralığı hacimce alt (LEL) ve% 14,3 olarak hacim (60 g / m) ile% 2.5 arasındadır (345 g / m) üst patlama sınırının (UEL) elde edilir. Patlama limitlerinin buhar basıncı fonksiyonu ile korelasyonu, −23 °C'lik bir düşük patlama noktası ve 8 °C'lik bir üst patlama noktası ile sonuçlanır. Patlama limitleri basınca bağlıdır. Basınçtaki bir azalma, patlama alanında bir azalmaya yol açar. Alt patlama limiti 100 mbar basınca kadar çok az değişir ve sadece 100 mbar'ın altındaki basınçlarda artar. Üst patlama limiti, azalan basınçla benzer şekilde azalır.
| Düşük basınç altında patlama limitleri (100 °C'de ölçülmüştür) | ||||||||||||
| Yazdır | mbar'da | 1013 | 800 | 600 | 400 | 300 | 250 | 200 | 150 | 100 | 50 | 25. |
| Alt patlama limiti (LEL) | hacimce % | 2.2 | 2.2 | 2.3 | 2.3 | 2.4 | 2.4 | 2.5 | 2.6 | 2.7 | 3.6 | 5.0 |
| g m -3 cinsinden | 53 | 53 | 53 | 55 | 57 | 58 | 59 | 61 | 63 | 86 | 119 | |
| Üst patlama limiti (UEL) | hacimce % | 14.3 | 14.0 | 13.7 | 13.4 | 13.2 | 13.1 | 13.1 | 13.1 | 12.5 | 10.3 | 9.0 |
| g m -3 cinsinden | 345 | 338 | 331 | 324 | 319 | 316 | 316 | 316 | 302 | 249 | 217 | |
| Azaltılmış basınç altında maksimum patlama basıncı | ||||||||||||
| Yazdır | mbar'da | 1013 | 800 | 600 | 400 | 300 | 200 | 100 | ||||
| Maksimum patlama basıncı (bar olarak) | 20 ° C'de | 9.3 | 7.5 | 5.5 | 3.6 | 2.7 | 1.8 | 0,8 | ||||
| 100 ° C'de | 7.4 | 4.5 | ||||||||||
Maksimum patlama basıncı 9,7 bar'dır. Sıcaklık arttıkça ve çıkış basıncı düştükçe maksimum patlama basıncı düşer. Genişlik sınır aralık 1.04 mm'dir (50 ° C) olduğu tespit edildi. Bu, patlama grubu IIA'ya bir atama ile sonuçlanır . Bir ile asgari ateşleme enerjisi gösterir 1.15 mJ, buhar-hava karışımı, son derece tutuşabilen. Ateşleme sıcaklığı 535 ° Hem C Bu nedenle madde T1 sıcaklık sınıfına girer . Artan basınç altında tutuşma sıcaklığında keskin bir düşüş gözlenir. Elektrik iletkenliği olan oldukça düşük 4.9 de · 10 -7 S · m -1 .
| Artan basınç altında ateşleme sıcaklıkları | ||||||||||||
| Yazdır | nakit | 1 | 2 | 4. | 6.8 | 16.5 | ||||||
| Ateşleme sıcaklığı | °C cinsinden | 535 | 345 | 290 | 265 | 250 | ||||||
Reaksiyonlar (seçim)
asetonun iyotlanması
Özel bir reaksiyon olarak, sözde-sıfır düzeni olarak adlandırılan reaksiyon kinetiğinin klasik bir örneği olarak asetonun iyodinasyonu buradadır . Sadece enol formu iyotlanabildiğinden, ancak aseton neredeyse %100 keton olduğundan, reaksiyon sırasında 2-propenol konsantrasyonu sabit olarak kabul edilebilir. C = C çift bağı , bir iyodür iyonunu bir mezomerik katyon oluşturmak üzere ayırarak iyodin ile reaksiyona girer , bu daha sonra bir protonu bir iyodür iyonuna aktarır.
Keto-enol dengesinin kurulması asit (ve ayrıca baz) katalizlenir. İyodinasyon bu nedenle ortaya çıkan hidrojen iyodür ( otokataliz ) tarafından büyük ölçüde hızlandırılır .
iyodoform reaksiyonu
Ancak baz eklenirken iyodoform reaksiyonu gerçekleşir :
dibenzalaseton oluşumu
Aseton, dibenzalaseton oluşturmak için bir alkali çözelti içinde benzaldehit varlığında reaksiyona girer . Reaksiyon, aldol yoğunlaşmasının genel mekanizmasına göre gerçekleşir .
Ayrıca benzalanilin sentezlenebilir - anilini at-in alkali çözelti aseton ile reaksiyona sokar , suyun eliminasyonu Schiff bazına ( azometin ) dönüşür . Hem dibenzalaseton hem de benzalanilin değerli maddelerdir çünkü nükleofiller tarafından saldırıya uğrayabilen çok reaktif çift bağlara sahiptirler.
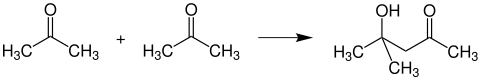
Diaseton alkol oluşumu
Bazik reaktiflerin etkisi altında iki aseton molekülünün aldol benzeri bir şekilde dimerleşmesine izin verilirse, diaseton alkol oluşur :
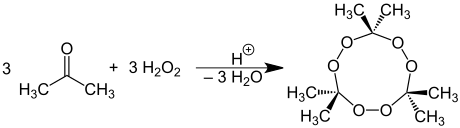
aseton peroksit oluşumu
Aseton reaksiyona girerek hidrojen peroksit formu patlatma eğilimli aseton peroksit :
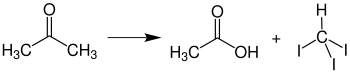
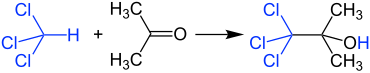
Kloroform ile reaksiyon
Aseton ve kloroform daha yüksek konsantrasyonlarda karıştırılmamalıdır, çünkü eser miktarda alkalin maddelerin varlığında 1,1,1-trikloro-2-metil-2-propanol üreten çok şiddetli bir reaksiyon meydana gelir . Bu nedenle de klorlu ve klorsuz solvent atıkları laboratuvarda ayrı olarak toplanmalıdır.
kullanmak
Aseton, kimya endüstrisindeki sayısız sentez için başlangıç malzemesidir. Esas olarak, akrilik cam veya pleksiglas olarak bilinen polimetil metakrilat (PMMA) üretimi için kullanılır . Bu amaçla, aseton önce asidik bir ortamda suyu kolayca ayıran hidrosiyanik asit eklenerek aseton siyanohidrine dönüştürülür ( nitril grubunun üçlü bağına konjugasyon nedeniyle çift bağın mezomerik stabilizasyonu ). Elde edilen 2-methylpropenenitrile dönüştürülür için metil metakrilat , konsantre bir karışım ilave edilerek sülfürik asit ve metanol , bir sonraki adımda a-akrilik cam üzere polimerize edilir.
Aseton üretimi için bir ön-madde olarak endüstriyel olarak kullanılan diaseton alkol ile aldol ilavesi için bir ön-madde olarak bu şekilde dolaylı olarak mesitil oksit ve metil izobütil keton .

Aseton ayrıca reçineler , katı ve sıvı yağlar, reçine , selüloz asetat ve ayrıca oje çıkarıcı ve plastik yapıştırıcı için yararlı bir çözücü olarak küçük miktarlarda kullanılır . Ayrıca, örneğin PU köpük tabancalarını temizlerken inşaat köpüğünün neden olduğu kirlenmeyi gidermek için de kullanılır . Etinde (asetilen) hacminin birçok katı çözünür .
Bazı ülkelerde , yakıtın daha eksiksiz yanmasını sağlamak için benzine veya dizele küçük oranlarda (1: 2000 - 1: 5000) aseton eklenir .
Olarak fotokimyasal devre kartı üretimi , aseton lehimleme işleminden önce devre kartının son yağ alma için kullanılır.
Diş hekimliğinde hazırlanan dentin yüzeylerini ve kök kanallarını temizlemek için aseton içeren solüsyonlar kullanılır .
biyokimya
Aseton, karaciğerde oluşan ve önemli ölçüde metabolize edilemeyen bir keton cismidir . Bu nedenle aracılığıyla salınır akciğerlerde istisnai içinde veya durumlar , içinden idrar ( asetonüri , bir semptom ait diabetes mellitus ). Diğer keton cisimleri asetoasetik asit ve 3-hidroksibütanoik asittir . Bunlar metabolizmada işlenebilir ve kaslar için enerji sağlanmasında rol oynarlar.
toksikoloji
Aseton cildi yağdan arındırdığı için ciltte kuruluğa neden olur. Bu nedenle temastan sonra etkilenen bölgeleri yağlamalısınız. Daha büyük dozların solunması bronşiyal tahrişe, yorgunluğa ve baş ağrısına neden olur. Çok yüksek dozların narkotik etkisi vardır .
hekzadöteroaseton
Dötoryumlanmış aseton (empirik formül: C 3 D 6 O) olarak da adlandırılan aseton- 6 , kullanılan bir çözücü olarak içinde , nükleer manyetik rezonans spektroskopisi (NMR).
Fiziksel özellikler, döteryumsuz bileşikten biraz farklıdır:
- Erime noktası: -93.8 ° C
- Kaynama noktası: 55,5 °C
- Yoğunluk: 0.872 g/ml (25°C)
- Kırılma indisi: 1.355 (20°C)
İnternet linkleri
- İçin Giriş Aseton içinde Tüketici Ürün Bilgisi Veritabanı
Bireysel kanıt
- ↑ üzerinde giriş aseton içinde bir Cosing veritabanı AB Komisyonu, 16 Şubat 2020 tarihinde erişti.
- ↑ bir b c d e f g h i j k l m n o ilgili Giriş aseton içinde bir GESTIS madde veritabanı IFA , 1 Şubat 2016 tarihinde erişilebilir. (JavaScript gerekli)
- ↑ Peter B. Fleming, Robert E. McCarley: Polinükleer Metal Halidlerin Kimyası. IV Bazı Niobyum ve Tantal M 6 X 12 n + Küme Türevlerinin Elektronik Spektrumları . İçinde: İnorganik Kimya . bant 9 , hayır. 6 , Haziran 1970, s. 1347-1354 , doi : 10.1021 / ic50088a011 .
- ↑ Asetonla giriş . İçinde: Römpp Çevrimiçi . Georg Thieme Verlag, 10 Kasım 2014'te erişildi.
- ↑ David R. Lide (Ed.): CRC Kimya ve Fizik El Kitabı . 90. baskı. (İnternet versiyonu: 2010), CRC Press / Taylor ve Francis, Boca Raton, FL, Dipole Moments, s. 9-52.
- ↑ David R. Lide (Ed.): CRC Kimya ve Fizik El Kitabı . 90. baskı. (İnternet versiyonu: 2010), CRC Press / Taylor ve Francis, Boca Raton, FL, Physical Constants of Organic Compounds, s. 3-4.
- ↑ üzerinde giriş Aseton içinde sınıflandırılması ve Etiketleme Envanteri Avrupa Kimyasallar Ajansı (AKA), 1 Şubat erişilen, 2016 Üreticileri veya distribütörler olabilir genişletmek uyumlaştırılmış sınıflandırma ve etiketleme .
- ↑ İsviçre Kaza Sigortası Fonu (Suva): Sınır değerler - mevcut MAK ve BAT değerleri ( 67-64-1 veya aseton için arama yapın ), 2 Kasım 2015'te erişildi.
- ↑ chemgapedia.de , öğrenme ünitesi aseton sentezi.
- ↑ a b I. M. Smallwood: Organik çözücü özellikleri el kitabı. Arnold, Londra 1996, ISBN 0-340-64578-4 , s. 27-29.
- ↑ D. Ambrose, CHS Sprake, R. Townsend: Organik Oksijen Bileşiklerinin Termodinamik Özellikleri. XXXIII. Asetonun Buhar Basıncı. İçinde: J. Chem. Thermodyn. 6, 1974, sayfa 693-700, doi: 10.1016/0021-9614 (74) 90119-0 .
- ↑ a b K. B. Wiberg, LS Crocker, KM Morgan: Thermochemical Studies of Carbonyl Compounds. 5. Karbonil Gruplarının İndirgenme Entalpileri. İçinde: J. Am. Kimya Soc. 113, 1991, sayfa 3447-3450, doi: 10.1021 / ja00009a033 .
- ^ CB Miles, H. Hunt: Yanma Isıları. I. Asetonun Yanma Isısı. İçinde: J. Phys. Chem. 45, 1941, sayfa 1346-1359.; doi: 10.1021 / j150414a002 .
- ↑ a b c R. Malhotra, LA Woolf: 278 K ila 323 K Sıcaklıklarda ve 400 Mpa'ya Kadar Basınçlarda Propanonun (Asetonun) Termodinamik Özellikleri. İçinde: J. Chem. Thermodyn. 23, 1991, sayfa 867-876, doi: 10.1016 / S0021-9614 (05) 80282-4 .
- ↑ Bir b J. Chao: Karbon Aralığı C Anahtar Organik Oksijen Bileşiklerin Termodinamik Özellikleri 1 C 4 . Bölüm 2. İdeal Gaz Özellikleri. İçinde: J. Phys. Kimyasal Referans Verileri . 15, 1986, sayfa 1369-1436, doi: 10.1063/1.555769 .
- ↑ a b c A. N. Campbell, RM Chatterjee: Aseton, kloroform benzen ve karbon tetraklorürün kritik sabitleri ve ortobarik yoğunlukları . İçinde: Kanada Kimya Dergisi . 47, 1969, s. 3893-3898, doi : 10.1139 / v69-646 .
- ↑ J. Schmidt: ISO 4126-10'a göre çok amaçlı sistemler için emniyet valflerinin tasarımı. İn: .. Chem. Techn Ing 83, 2011, sayfa 796-812. Doi: 10.1002 / cite.201000202 .
- ↑ KK Kelley: İzopropil alkol ve asetonun 16 ila 298 ° K arasındaki ısı kapasiteleri ve karşılık gelen entropiler ve serbest enerjiler. İçinde: J. Am. Kimya Soc. 51, 1929, sayfa 1145-1150, doi: 10.1021 / ja01379a022 .
- ^ A b V. Majer, V. Svoboda: Organik Bileşiklerin Buharlaşmasının Entalpileri: Eleştirel Bir İnceleme ve Veri Derleme. Blackwell Bilimsel Yayınları, Oxford 1985, s. 300.
- ↑ a b c d e E. Brandes, W. Möller: Güvenlikle ilgili parametreler. Cilt 1: Yanıcı Sıvılar ve Gazlar. Wirtschaftsverlag NW - Verlag für neue Wissenschaft, Bremerhaven 2003.
- ↑ a b c d D. Pawel, E. Brandes: Araştırma projesine ilişkin nihai rapor, güvenlikle ilgili parametrelerin atmosfer basıncının altındaki basınca bağımlılığı. ( Memento içinde 2 Aralık 2013 , Internet Archive ), Physikalisch.Technische Bundesanstalt (PTB), Braunschweig 1998.
- ↑ JB Fenn: Yalın Alev Alabilirlik Sınırı ve Minimum Kıvılcım Ateşleme Enerjisi. Ticari Akışkanlar ve Saf Hidrokarbonlar. In: Ind. Müh. Chem. 43, 1951, sayfa 2865-2869.; doi: 10.1021 / ie50504a057 .
- ↑ HF Calcote, CA Gregory, CM Barnett, RB Gilmer: Spark Ignition - Effect of Molecular Structure. In: Ind. Müh. Chem 44, 1952, s. 2656-2662; doi: 10.1021 / ie50515a048 .
- ↑ Tehlikeli maddeler için teknik kural TRGS 727, BG RCI broşürü T033 Elektrostatik yükler nedeniyle tutuşma tehlikelerinin önlenmesi , durum Ağustos 2016, Jedermann-Verlag Heidelberg, ISBN 978-3-86825-103-6 .
- ^ FA Carey, RJ Sundberg: Organik Kimya. Wiley-VCH Verlag, 2004, ISBN 3-527-29217-9 .
- ↑ Lutz Roth, Ursula Weller: Tehlikeli kimyasal reaksiyonlar , ISBN 3-609-73090-0 , ecomed security; 2005.
- ↑ Döteryumlu Aseton için harici tanımlayıcılar veya veritabanı bağlantıları : CAS numarası:666-52-4 , EC numarası: 211-563-9, ECHA InfoCard: 100.010.514 , PubChem : 522220 , ChemSpider : 455535 , Wikidata : Q1032873 .
- ↑ Aseton-d6 veri sayfası ile ilgili Sigma-Aldrich , 31 Ağustos 2019 (erişilen, PDF ).
- ↑ Döteryumsuz bileşik için 0.791 g/ml (25 °C) ile karşılaştırıldığında. Aseton veri sayfası ile ilgili Sigma-Aldrich , 31 Ağustos 2019 (erişilebilir PDF ).