Çift bağ
Bir çift bağ şeklidir kovalent bağ içeren dört bağlama elektronları . Böylece iki atom, iki bağ elektron çifti aracılığıyla birbirine bağlanır . Olarak yapısal formüllerde, çift bağlar bağlı atomları arasında iki paralel çizgi (=) olarak temsil edilir.
Birçok atom birbiriyle çift bağ oluşturabilir. En yaygın işlevsel gruplar ya da maddelerin sınıfları ikili bağlar ile olan alkenler (C = C), karboniller (C = O), sülfoksitler (S = O), iminler (C = N) ve azo grubu (-N = N-) .
Çift bağlar, tek bağlardan daha güçlü ve daha kısadır. Bağ derecesi ikidir. Çift bağlar elektron açısından zengindir, bu da onları reaktif hale getirir.
Tarih
Çift bağın iki çift çizgi ile temsili Joseph Loschmidt tarafından tanıtıldı . Yaklaşık 1865 Ağustos Wilhelm von Hofmann , doymuş ve doymamış alkanları belirtmek için -an, -en, -in sonlarını tanıttı .
Detaylı Açıklama

2. periyottaki bir molekülün çift bağ ile bağlanma ilişkileri sp 2 - hibrit orbitaller ile tanımlanabilir . Sp tür bir atomun, komşu atomlar 2 hibridizasyon bir düzlem (molekül düzlemseldir) olarak ifade edilmiştir. Bağlı atomlar arasındaki açılar genellikle 120 ° 'ye yakındır ( VSEPR modeline bakın ), bağlanan atomlar arasındaki mesafe yaklaşık 1,34 A'dır. Kalan elektron, moleküler düzleme dik olan saf p karakterine sahip bir yörüngede bulunur. Çift bağ ile birbirine bağlanan iki atomun her biri, tek başına işgal edilmiş bir p yörüngesine sahiptir . Bu ikisinin kombinasyonu, bir bağ π orbitali ve bir antibonding π * orbitali oluşturur.
Bu tür çift bağ 2. dönemle sınırlı değildir, ancak daha yüksek dönemlerin elemanları arasındaki çift bağlarda farklı bağ desenleri bulunur. Bunun nedenleri, bir yandan, daha büyük atomlar için genellikle daha düşük homonükleer bağlanma enerjileri ve diğer yandan, s ve p değerlik orbitallerinin daha düşük bir hibridizasyon eğilimidir . Bazı durumlarda, bu fenomenin çakışması, çift bağ sisteminin altında yatan moleküler fragmanları bağlanabilir bir duruma getirmek için gereken enerjinin, daha sonra salınan bağlanma enerjisi tarafından artık uygulanamayacağı anlamına gelir. Bu gibi durumlarda, bu fragmanlar (yani, karben-homolog veya analog moleküller) izole edilebilir bileşikler olarak elde edilir veya dimerizasyon, bir çift Lewis asit-baz reaksiyonu yoluyla gerçekleşir ve iki verici-alıcı bağı (bir çift datif bağ) ile sonuçlanır. Örneğin, daha yüksek karbon homologları durumunda gözlenen böyle bir çift bağ, karakteristik bir yapı (ikame edicilerin çapraz bükülmesi) ve bağı ayırmak için gereken düşük enerji ile tanınabilir. Ayrışma enerjisi, normal bir kovalent tekli bağdan önemli ölçüde daha küçük olabilir. Bu tür çift bağ sistemleri tipik örnekleri distannenes olan (R, 2 , Sn = SnR 2 ) ve Diplumbene (R 2 Pb = PBR 2 ).
Bağlama π ve antibonding π * orbitali arasındaki enerji boşluğu genellikle karşılık gelen bir σ ve bir antibonding σ * orbitali arasındaki enerji boşluğundan daha küçüktür. Eşlenik çift bağ durumunda , uyarma enerjisi o kadar düşer ki, görünür ışık bir elektronu boş bir yörüngeye kaldırmak için yeterli olabilir. Konjuge çift bağ sayısı ne kadar fazlaysa, o kadar az enerji (daha uzun dalga ışığı) gerekir (ayrıca bkz: Kutudaki parçacıklar ). On bir konjuge çift bağlı karoten durumunda , mavi ışık emilir ve molekül turuncu görünür ( tamamlayıcı renk turuncu , mavi bileşenin yayılan beyaz ışıktan çıkarılmasından kaynaklanır ).
Bağ uzunlukları ve bağ açıları
Konjuge olmayan sistemlerde iki atom arasındaki çift bağların bağ uzunlukları, aynı atomlar arasındaki karşılık gelen tekli bağlardan daha kısadır.
Seçilen çift bağların bağ uzunlukları ve bağ açıları 
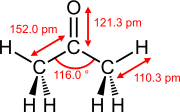

Eten (etilen) aseton Dimetil sülfoksit
isimlendirme
Bir çift bağ etrafında dönme kolaylıkla mümkün değildir. Her iki bağlanma partnerinin iki farklı ikame edicisi varsa , birbirlerine göre konumlarına göre cis ve trans izomerler arasında bir ayrım yapılır .
Tam olarak tek bir bağ ile ayrılan birkaç çift bağ , konjuge , doğrudan birbirine bitişik olanlar kümülatif olarak ve birden fazla tek bağ varsa, bir sonraki çift bağa kadar izole edilmiş olarak adlandırılır .
Bir çift bağ ile moleküllerin tipik kimyasal reaksiyonları
- C = C çift bağ ( alkenler ):
-
çift bağa
elektrofilik ekleme
- Başka bir (elektrofilik) molekül, ya E + (E + = elektrofil) ve iyonik bir ara bağın saldırısından sonra moleküle bağlanır , çift bağı kırar veya daha büyük atomlu elektrofiller (örn. Brom ) durumunda, bir halka oluşturur. şeklinde, iyonik bir Ara aşama ("- onium iyonu", burada ayrıca bromonyum iyonu) geri kalanın arka tarafında müteakip saldırı (örnekte Br - ).
-
çift bağa
radikal ekleme
- bağı homolitik olarak (iki köke) (örneğin klor ) kolayca ayrılabilen bir molekül, ışık (UV) altında iki köke bölünür ve daha sonra çift bağa saldırır.
-
çift bağa
elektrofilik ekleme
- C = O çift bağ ( karbonil , keton , aldehit , karboksilik asit , karboksilik asit ester ):
- İndirgenmesi C = O için bağ alkoller gibi indirgeyici reaktif maddeler ile , hidrojen ya da Grignard reaksiyonu .
- C = O bağının (sadece aldehit) bir karboksilik aside oksidasyonu .
- Passerini reaksiyonu .
- C = N çift bağ
- Eklenmesi hidrosiyanik asit α-amino nitril ile oluşturulmuş olmasıdır.
- Ugi reaksiyonu
- perisiklik reaksiyonlar
Diğer reaksiyonlar için, ayrıca bkz. Reaksiyonlar , kümülatif çift bağ .
C = C çift bağlarının tespiti
C = C çift bağlı organik bileşiklerin, yani alkenlerin oldukça spesifik olmayan bir tespiti, brom suyu kullanılarak mümkündür. Bir alken varsa, Br 2 ile sarıya boyanan brom suyu , çalkalandıktan sonra numune ile renksizleştirilir. Alkenden bir ekleme reaksiyonu yoluyla bir bromoalkan oluşturulur . Ayrıntılar için alken tespitine bakınız .
Ayrıca bakınız
- Çift bağ kuralı
- Çift bağ eşdeğeri
- Cis - trans izomerizmi [( EZ ) izomerizmi]
- π-π etkileşimi
Bireysel kanıt
- ^ Siegfried Hauptmann : Organik Kimya , 2. gözden geçirilmiş baskı, VEB Deutscher Verlag für Grundstoffindindustrie, Leipzig, 1985, s.54 , ISBN 3-342-00280-8 .




