Tartarik asit
| Yapısal formül | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||||||||||
| D - (-) - şekil (sol üst) ve L - (+) - şekil (sağ üst) ve meso şekli (alt) | |||||||||||||||||||
| Genel | |||||||||||||||||||
| Soyadı | Tartarik asit | ||||||||||||||||||
| diğer isimler |
|
||||||||||||||||||
| Moleküler formül | Cı 4 H 6 O 6 | ||||||||||||||||||
| Kısa açıklama |
ekşi bir tada sahip renksiz ve kokusuz katı |
||||||||||||||||||
| Harici tanımlayıcılar / veritabanları | |||||||||||||||||||
| |||||||||||||||||||
| özellikler | |||||||||||||||||||
| Molar kütle | 150.09 g mol -1 | ||||||||||||||||||
| Fiziksel durum |
sabit |
||||||||||||||||||
| yoğunluk |
|
||||||||||||||||||
| Erime noktası |
|
||||||||||||||||||
| p K S değeri |
|
||||||||||||||||||
| çözünürlük |
|
||||||||||||||||||
| güvenlik talimatları | |||||||||||||||||||
| |||||||||||||||||||
| toksikolojik veriler |
7500 mg kg -1 ( LD Lo , sıçan , oral , L - (+) - tartarik asit) |
||||||||||||||||||
| Olabildiğince ve alışılageldiği kadarıyla SI birimleri kullanılır. Aksi belirtilmedikçe, verilen veriler standart koşullar için geçerlidir . | |||||||||||||||||||
Şarap asidi olarak da bilinen, 2,3-dihidroksi veya 2,3-dihidroksibutandioik veya tartarik asit olarak Latince, Acidum tartaricum ile ve İngiliz tartarik asit Yunanca ifade eder tartaros çünkü aşındırıcı, yakıcı etkisinin, cehennem.
α- hidroksikarboksilik asit grubundaki bir dikarboksilik asittir . Şeker dikarboksilik asitlere ( aldarik asitler ) aittir , bunların tuzlarına ve esterlerine tartratlar denir . L - (+) - tartarik asit, örneğin üzümlerde bulunur ve AB'de gıda katkı maddesi olarak onaylanmıştır E 334 . Almanya'da, toplam asidite ve şarap - tartarik asit olarak hesaplanan - başka asitler, özellikle de çok sayıda, ancak aynı zamanda verilir, malik asit , meydana şarap .
Üzüm asidi , tartarik asidin rasematının adıdır . Suyun moleküller arası eliminasyonu , aynı zamanda E 353 adı altında bir gıda katkı maddesi olarak kullanılan polimer metatartarik asidi üretir .
Öykü
Tartarik asit, bunun tuzu, keşfinden önce potasyum hidrojen tartrat , veya tartar , kolayca çökelirken nedeniyle şarap zayıf su çözünürlüğü göstermelerinden dolayı, bir asit olduğu düşünülen ve kimyagerler kolaylıkla çözünür tartarik asit daha tanımak için bu nedenle daha kolay oldu . O zamanlar, bugün hala yaygın olarak kullanılan şarap ruhu terimi, saf alkol için yaygındı. 1732'de Weinstein, Boerhaave tarafından katı bir asit olarak listelendi . 1764'te Marggraf , tartarda bir alkali metal tespit etti ve bunun üzerine onu kalsiyum ile kalsiyum tartarat'a ayrıştırdı ve daha detaylı incelemedi. 1769 yılına kadar tartarik asidin kaşifi olarak kabul edilen Scheele , kalsiyum tartaratı sülfürik asitle ayrıştırdı ve ayrılan kristal asidi "tartarik asit" olarak adlandırdı. Tartar, kısa bir süre sonra bu asidin asidik potasyum tuzu olarak tanındı .
1819'da üzüm asidi (Vosik asit), üretici Karl Kestner tarafından tartarik asit üretiminin bir yan ürünü olarak keşfedildi. İzomerizm tartarik asit tarafından kurulmuştur Gay-Lussac 1826'da ve daha ayrıntılı olarak ele tarafından Pasteur , her ne kadar bu süre sadece en optik açıdan aktif "sağa tartarik asit", diğer bir deyişle L "rasemik asit" olarak adlandırılan -tartarik asit ve üzüm asidi, , biliniyordu. Pasteur, bu asitlerin sodyum amonyum tuzunu yaptı ve bu süreçte kiraliteyi keşfetti . Pasteur, kristalleri sol ve sağ örneklere ayırmak için bir büyüteç ve cımbız kullandı.
Pasteur koymak enantiomerik sodyum amonyum tartaratlar ayrılmış gelen rasemat çözelti içine geri ve incelenen dönme açısının değerini de polarimetre . Optik olarak aktif olmayan üzüm asidinden elde edilen tuzların her iki çözeltisinin de optik olarak aktif olduğunu ve L- tartarik asitten elde edilen sodyum amonyum tuzu ile aynı spesifik rotasyonu sergilediğini , ancak zıt işaretlerle bulmuştur. Bundan, Pasteur, üzüm asidinin saf bir madde olmadığı , saat yönünde ve saat yönünün tersine tartarik asidin eşit bir karışımı, yani bir rasemat olduğu sonucuna vardı . Eşit parçalardaki iki enantiyomerin karışımı için kullanılan rasemat terimi, üzüm asidinin (Acidum racemicum) Latince adından türetilmiştir.
Pasteur'ün deneyinin yorumları, üzüm asidinin L - ve D - tartarik asidin bir rasematı olduğu gerçeğiyle sınırlı değildir . Pasteur, optik aktivitenin tartarik asit molekülünün kendisinin bir özelliğinin sonucu olması gerektiğini fark etti. Ancak 1874'e kadar Le Bel ve daha sonra kimyada ilk Nobel Ödülü sahibi olan van 't Hoff , bunu moleküler yapı temelinde bağımsız olarak açıklayamadı. "Dört farklı nesnenin bir tetrahedronun köşelerinde iki farklı şekilde düzenlenebileceğini ve bu düzenlemelerin birbiriyle uyumlu hale getirilemeyen görüntü ve ayna görüntüsü gibi ilişkili olduğunu " bilerek , dört radikalin bir karbon atomuna bağlı olduğunu varsaydılar. tetrahedral olarak düzenlenmiştir. Buna dayanarak, optik olarak aktif moleküllerin dört farklı radikale sahip en az bir karbon atomu, yani bir asimetrik karbon atomu içerdiğini varsaydılar. "Optik olarak aktif olmayan organik maddeler bu nedenle ya asimetrik bir karbon atomu içermezler ya da iki enantiyomerin eşit parçalarının karışımlarıdır."
Van 't Hoff ve Le Bel, bir yandan karbon atomunun tetrahedral geometrisini tanıdı ve diğer yandan organik maddelerin optik aktivitesi için kesin bir açıklama sağladı. Sadece mezo- bileşikleri tanımları kapsamına alınamadı; mezo- tartarik asidin yapısı ancak çok sonra keşfedildi . Uzun bir süre, tartarik asidin hangi enantiyomerinin ışığın polarizasyon düzlemini sağa ve hangisinin sola çevirdiği de bilinmiyordu . 1951 yılına kadar Bijvoet, L- tartarik asidin dekstrorotator (+) enantiyomer ve D- tartarik asitin levorotator (-) enantiyomer olduğunu netleştirmek için sodyum rubidyum tartarat bazlı özel bir X-ışını yöntemini kullanamadı . Tartarik asidi diğer kimyasal bileşiklere dönüştürerek bu, diğer birçok enantiyomer çifti için de açıklığa kavuşturulabilir.
oluşum
L - (+) - tartarik asit ve kalsiyum, potasyum ve magnezyum tuzları özellikle asma, üzüm ve asmanın yapraklarında olduğu kadar karahindiba, şeker pancarı, demirhindi , olgunlaşmamış üvez meyvelerinde , iğ tohumlarında bol miktarda bulunur. ağaç , yapraklarında agaves siyah, biber içinde, ananas ve diğer birçok meyvelerde. Şarap yapımı sırasında , tartarik asidin az çözünür tuzları , şarap fıçılarının veya şarap şişelerinin dibinde tartar olarak birikir . D - (-) - tartarik asit olarak adlandırılan değil, tamamen doğru doğal olmayan tartarik asit, yalnızca Batı Afrika yapraklarında bulunan orkide ağacı Bauhinia reticulata . Mezo formu doğada mevcut değil.
Üretme
Tartarik asit, tartardan kalsiyum tartrata dönüştürüldükten sonra üretilebilir. Tartarik asit bu sülfürik asit ile açığa çıkabilir, yan ürün olarak alçıtaşı oluşur . Mezo formu oksitlenmesi suretiyle üretilebilir fumarik asit ya da maleik anhidrit ile , hidrojen peroksit , potasyum permanganat ya da diğer perasitler .
Penicillium glaucum sadece L - (+) - tartarik asidi parçaladığından , rasemattan Penicillium glaucum fırça kalıbı ile parçalanarak saf D - (-) - tartarik asit elde edilebilir .
özellikler
Tartarik asit molekülündeki iki hidroksil grubunu taşıyan iki karbon atomu stereo merkezlerdir . Bu merkezlerin konfigürasyonuna bağlı olarak, D - (-) - tartarik asit [eşanlamlı: ( 2S , 3S ) -tartarik asit], L - (+) - tartarik asit [eş anlamlı: ( 2R , 3R ) -tartarik asit] veya optik olarak aktif olmayan mezo - Tartarik asit. Gelen mezo formu, stereomerkezlerinde biridir ( R ) - , diğer ( S ) ile yapılandırılmış . Sağ elini kullanan L - (+) - şekli genellikle doğada bulunur . Tartarik asit [iki enantiomerleri L - (+) - tartarik asit ve D - (-) - tartarik asit] sadece açısından, fiziksel ve kimyasal özellikleri bakımından farklılık dönme değeri karşı . Lineer polarize ışığın dönme değeri α için L (+) - - tartarik asit + 12.7 ° ile D - (-) - tartarik asit -12.7 ° aynı ölçüm koşulları altında. Tüm mezo bileşiklerde olduğu gibi mezo- tartarik asidin dönme değeri ± 0°'dir. Tartarik asidin üç stereoizomerinin hepsinin fizyolojik özellikleri farklıdır.
| tartarik asit izomerleri | ||||
| Soyadı | D - (-) - tartarik asit | L - (+) - tartarik asit | mezo- tartarik asit | |
| diğer isimler | ( 2S , 3S ) -tartarik asit | ( 2R , 3R ) -tartarik asit | ||
| Yapısal formül |

|
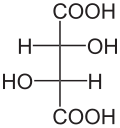
|
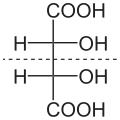 Kesikli çizgi: ayna düzlemi |
|
| CAS numarası | 147-71-7 | 87-69-4 | 147-73-9 | |
| 133-37-9 [ DL - (±) karışım] | ||||
| 526-83-0 (belirtilmemiş) | ||||
| EC numarası | 205-695-6 | 201-766-0 | 205-696-1 | |
| 205-105-7 [ DL - (±) karışım] | ||||
| 610-885-0 (belirtilmemiş) | ||||
| ECHA bilgi kartı | 100.005.178 | 100.001.606 | 100.005.179 | |
| 100.004.642 [ DL - (±) karışım] | ||||
| 100.121.903 (belirtilmemiş) | ||||
| PubChem | 439655 | 444305 | 440015 | |
| 875 (belirtilmemiş) | ||||
| Vikiveri | Q23034947 | Q18226455 | Q12447642 | |
| Q4111665 [ DL - (±) karışım] | ||||
| Q411237 (belirtilmemiş) | ||||
Tartarik asidin alkali tuzlarıdır mümkün için kompleks ( bağlama ) , bakır (II) iyonları bir in alkali çözelti ve böylece (çözelti içinde tutmak Fehling çözeltisi ). Hidrojen tartratlar ayrıca iki bazik, nispeten güçlü bir asit olarak oluşturulabilir. Eşit miktarda L - (+) - ve D - (-) - tartarik asit ( rasemat ) karışımına üzüm asidi denir , erime noktası 205-206 ° C. Bu karışıma bazen rasemik tartarik asit denir. Değişken oranlarda L - (+) -, D - (-) - ve mezo -tartarik asit ile tartarik asidin üç stereoizomerinin bir karışımı, tartarik asit izomerlerinin bir karışımı olarak işlem görür.
kullanmak
Tartarik asit için çoğu sentez işleminin ürünü olduğu için daha büyük ölçekte sadece L- tartarik asit kullanılır. Üretilen L (+) - tartarik asidin %50'si gıda sanayi ve ilaç sektöründe, diğer yarısı ise teknik uygulama alanlarında kullanılmaktadır.
Tartarik asit, dezenfektanlarda bir bileşen olarak kullanılır. Kural olarak, bunun L - veya D - tartarik asit, rasemik olarak karıştırılmış tartarik asit veya başka bir karışım oranı olup olmadığı belirtilmemiştir .
Gıda katkı maddesi olarak kullanın
Tartarik asidin en belirgin uygulaması, gıda katkı maddesi olarak kullanılmasıdır. Bu alanda E 334 olarak adlandırılan L- tartarik asit, sadece birçok gıdada doğal olarak bulunmaz, aynı zamanda tadı ve koruyucu özelliğinden dolayı birçok karışık gıda ürününe de katılır. Tartarik asit, dondurma, yapay bal , meyve, limonata ve alkolsüz içecekler, jöle , şarap sakızları ve şekerlemelerin hazırlanmasında kullanılır, örn. B. kremleri ve köpükleri stabilize etmek için ve düşük asitli şarapların asitleştirilmesinde kullanılır. Tartarik asit terimi de pişirme kitaplarında yanlış kullanılmaktadır. Sıçanlarla yapılan hayvan deneylerinde L- tartarik asidin oral toksisitesi son derece düşüktü; sıçanlar için oral LD Lo 7500 mg / kg vücut ağırlığıydı.
Bir lakton olarak bir polimer olan metatartarik asit (E 353) esas olarak tartarik asidi stabilize etmek için kullanılır; kolloidal koruma olarak şaraptaki tartarın kristalleşmesini önler .
Teknik kullanımlar
Tartarik asit, ipek hissi ve pürüzsüz hale getirmek de dahil olmak üzere birçok teknik alanda da kullanılmaktadır . Tartarik asidin metallerle kompleks oluşturma yeteneği önemlidir : Bu komplekslerde, metal katyonu tartarik asit tarafından diğer organik asitlerin çoğuna göre daha sıkı bağlanır . Bu, sayısız olası kullanımla sonuçlanır. Potasyum sodyum tartarat , örneğin Fehling solüsyonunda kompleks oluşturucu bir ajan olarak ve tartarik asit, bakır ve pirinç parçaların yüzey işlemi için kullanılır. İkincisi, burada toksik ağır metalleri bağladığı için ağır metallerle kirlenmiş zeminleri temizlemek için de kullanılabilir , ancak kendisi biyolojik olarak parçalanabilir. Çimento ve sıvaya ilave edilirse kalsiyum iyonlarını kompleks yaparak prizini geciktirerek çalışma ve deforme olma süresini uzatır. Aynı zamanda bir indirgeyici ajan olarak ve organik bazların çözülmesi için de hizmet eder . Modern Organik sentezde, LiAIH 4 -tartarik asit türevleri gibi TADDOL olan önemli şiral reaktifler veya katalizörler enantioselektif azaltılması ketonlar ve stereoselektif sentez işlemleri.
İnternet linkleri
Bireysel kanıt
- ^ Alfred Henry Allen: Ticari Organik Analiz. Cilt I, 2. Baskı, J. & A. Churchill, 1885, s. 435, çevrimiçi olarak babel.hathitrust.org adresinde, 13 Kasım 2017'de erişildi.
- ↑ a b c d Rudolf Wagner : Die Chemie. 6. baskı, Wiegand, 1873, s. 515.
- ↑ Hans Meyer: Organik kimyasal yöntem ders kitabı. İkinci cilt, Springer, 1933, ISBN 978-3-662-37141-1 (yeniden baskı), s. 161.
- ↑ ilgili kayıt E 334: Tartarik asit (L (+) -) gıda katkı maddeleri Avrupa veritabanında, 27 Haziran 2020 tarihinde erişilebilir.
- ↑ a b Veri sayfası D - (-) - tartarik asit (PDF), Carl Roth'tan , 7 Ağustos 2010'da erişildi.
- ↑ a b c K. Peter C. Vollhardt: Organik Kimya. 1. baskının 1. düzeltilmiş yeniden basımı, VCH, Weinheim 1990, ISBN 3-527-26912-6 , s. 166.
- ↑ bir b c Merck Index . Kimyasallar, İlaçlar ve Biyolojik Ansiklopedisi. 14. baskı, 2006, ISBN 978-0-911910-00-1 , s. 1557-1558.
- ↑ a b c d e Tartarik asit girişi . İçinde: Römpp Çevrimiçi . Georg Thieme Verlag, 12 Kasım 2014'te erişildi.
- ↑ bir B ile ilgili kayıt tartarik asit içinde bir GESTIS madde veritabanı IFA , 10 Ocak 2017 tarihinde erişilebilir. (JavaScript gerekli)
- ↑ Bir b üzerinde giriş Tartarik asit içinde ChemIDplus veri tabanından Tıp Amerika Birleşik Devletleri Ulusal Kütüphanesi (NLM), 25 Mart 2021 tarihinde erişti.
- ^ Johann Christian Poggendorff : Biyografik-edebi özlü sözlük. 1. Cilt: A – L , Barth, 1863, sayfa 1251.
- ↑ a b H. Hart, LE Crane, DJ Hart: Organik Kimya. 2. baskı, WILEY-VCH Verlag, Weinheim 2002, ISBN 978-3-527-30379-3 , s. 193.
- ↑ E. Broad Maier, G. Jung: Organik Kimya. 4. baskı, Thieme Verlag, 2001, ISBN 978-3-13-541504-8 .
- ↑ S. Görtges: Tartarik stabilizasyon için metatartarik asit ( İnternet Arşivinde 15 Ağustos 2016 tarihli Memento ) (PDF). İçinde: İsviçre. Z. meyve yetiştirme. 1, 2002, s. 8-9.
- ↑ D. Seebach , AK Beck ve A. Heckel: TADDOL'ler, Türevleri ve TADDOL Analogları: Çok Yönlü Kiral Yardımcılar. İçinde: Angewandte Chemie Uluslararası Baskı . 40, 2001, sayfa 92-138, PMID 11169693 .
- ↑ M. Aoki ve D. Seebach : TADDOL'den bir Hidroperoksit olan TADOOH'nin Hazırlanması ve Yüksek Enantiyoface- ve Enantiyomer-Farklı Oksidasyonlarda Kullanımı. İçinde: Helvetica Chimica Acta . 84, 2001, sayfa 187-207, doi : 10.1002 / 1522-2675 (20010131) 84: 1 <187 :: AID-HLCA187> 3.0.CO;2O .


