Ubikitin
| Ubikitin | ||
|---|---|---|

| ||
| Şerit modeli | ||
| İnsan proteininin özellikleri | ||
| Kütle / uzunluk birincil yapısı | 8.5 kDa / 76 amino asit | |
| Tanımlayıcı | ||
| Gen isimleri | RPS27A ; UBA52; UBB; UBC | |
| Harici kimlikler | ||
| Oluşum | ||
| Ana takson | Ökaryotlar | |
Ubikitin , tüm ökaryotik hücrelerde ve hücre tiplerinde bulunabilen küçük bir proteindir - yani ökaryotlarda her yerde bulunur - ve çeşitli hücre işlemlerinin düzenlenmesinde rol oynar.
Bu bir enzimatik başka proteinlere bağlanan vasıtasıyla ubikuitin protein ligazlar , özellikleri değiştirilir bundan ubikitinasyon . Ubikuitin bağlarının sayısına ve türüne bağlı olarak, bir ubikitinleştirilmiş hedef protein, diğer proteinlerle etkileşiminde teşvik edilebilir veya engellenebilir, aktivitesi etkilenebilir, hücredeki lokalizasyonu değiştirilebilir veya bozunması hızlandırılabilir. Bir zincire eklenen birkaç ubikuitin, proteini işaretler, böylece proteazomda bozunma için protein kalite kontrolünde poli-ubikitine olur . Ubiquitinasyonlar ayrıca transkripsiyon ve translasyonu düzenlemek için önemlidir , sinyal transdüksiyonu ve endositozla ilgilidir, DNA onarımında yer alır ve hücre döngüsü , hücre farklılaşması ve enflamatuar reaksiyonların düzenlenmiş süreçlerinde meydana gelir .
Ubiquitinasyonun kendisi, üç ana adımı farklı enzimler tarafından katalize edilen çok fazlı bir süreçtir: ubikitin-aktive edici (E1), ubikitin-konjugasyon (E2) ve son olarak ubikitini, belirli substrat proteinlerine bağlayan ubikitin ligazları (E3). Farklı yollar.
Öte yandan, spesifik etkisi altında diğer şeylerin yanı sıra bağlı ubikuitin moleküllerinin tekrar çıkarılabildiği bir dizi farklı desubikitinasyon enzimi (DUB) vardır.
Ubikitinasyon ve her yerde bulunma adı verilen, proteinlerin translasyon sonrası bir modifikasyonudur . Karşılaştırılabilir modifikasyonlar , bahsedilen SUMO , Urm1 veya Nedd8 gibi karşılık gelen sumoilasyon , Urmylierung veya neddilasyon gibi, ubikitin benzeri proteinlerin bağlanmasıdır . Ek olarak, bazı prokaryotlar , örneğin Mycobacterium tuberculosis , prokaryotik ubikuitin benzeri protein (Pup) olarak adlandırılan ubikitine benzer bir protein bilir .
Ubikitin 1975'te keşfedildi ( her yerde bulunan immünopoietik polipeptit olarak adlandırılır ) ve sonraki yıllarda daha ayrıntılı olarak karakterize edildi. 1980'lerin başında, Aaron Ciechanover , Avram Hershko ve Irwin Rose , ubiquitin sisteminin temellerini araştırdıkları için Nobel Kimya Ödülü'ne layık görüldü .
yapı
Ubikitin, 76 amino asitten oluşur ve 8,5 kDa'lık bir moleküler kütleye sahiptir . Yapısı evrim sırasında çok az değişmiştir , bu nedenle yüksek oranda korunmuştur . İnsanlardaki protein ve tek hücreli maya Saccharomyces cerevisiae , 76 amino asitten sadece 3'ünde farklılık gösterir.
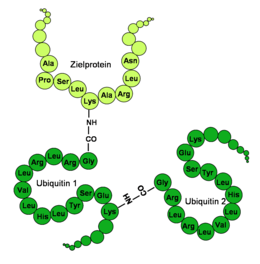
Ubikitin küresel bir şekle sahiptir, sadece son dört C- terminali amino asit çıkıntı yapar. Önemli fonksiyonel amino asitlerdir Cı -terminal glisin 76. pozisyon (G76) ve (G) , lizinlerin 48. (K48) ve 63. pozisyon (K63), (K) bir amino asit sekansı . Via Cı G76 ilgili terminal karboksi grubu, ubikitin olduğu kovalent bağlanmış belirli lysines, sistein, serinler, treonin ya da K arasında terminalinde edilecek protein etiketli . Ek ubikuitin molekülleri, lizinler yoluyla önceden bağlanmış bir ubikitine bağlanabilir, böylece bir ubikitin zinciri oluşturulur. Bir ubikitin toplam yedi lizin içerdiğinden, bir ubikitinin en az yedi farklı bileşiği mümkündür.
İnsan ubikuitin için tek harf kodlu amino asit dizisi - K48, K63 ve G76, koyu renkle vurgulanmıştır:
| N Vadeli MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPDQQRLIFAGKQLEDGRTLSDYNIQKESTLHLVLRLRGG C uzun dönem |
Ubiquitination Mekanizması
Hedef proteinleri ubikitin ile işaretleme sürecine ubikitinasyon veya her yerde bulunma adı verilir . Bu işlem gerektirir - bir şekilde Sumoilasyonun , Urmylierung veya neddylation - birbirini takip eden bir çok reaksiyon aşamalarının üç ve enzim katalize , ubikuitin-protein ligaz göre, reaksiyon dizisinin E1 (aktive edilmesi ve modifikasyonu enzim), E2 (modifikasyon olarak konjüge edici enzim) ve E3 (ayrıca E3 ligaz ) gösterilir.
İlk aşamada ubikitin, C terminal karboksi grubu (G76) ile E1 enziminin bir sisteini arasında bir tioester bağı ile bağlanır ve bu nedenle "aktive edilir". Bu aktivasyon enerjiye bağlıdır; Enerji bölme ile sağlanır ATP içine AMP ve pirofosfat . Modifiye edici molekülü aktive etmek için spesifik bir E1 enzimi vardır ve bitkilerde ubikitin için iki E1 enzimi bile vardır.
Ubikitin E1'e bağlandıktan sonra ubikitin, E2 enzimine aktarılır. Tek başına mayadaki ubikitin için on birden fazla farklı E2 enzimi bilinmektedir; diğer organizmalarda sayıları daha da fazladır (her biri Sumo1 ve Nedd8 için belirli bir E2 enzimi bulunurken).
Son adımda ubikuitin, spesifik E3 ligazları tarafından hedef proteine aktarılır. Burada, ubikitinin C- terminal glisini ile hedef proteinin bir lizini arasında bir izopeptit bağı oluşturulur . Klasik bir peptit bağının aksine , bağlanma ortağı olarak görev yapan α-amino kalıntısı değil, lizinin ε-amino kalıntısıdır. Ek olarak, ubikuitinler başka yollarla da bağlanabilir ve lizin içermeyen proteinlerin de her yerde bulunduğu bulunmuştur. Ubikitin tarafından modifiye edilen hedef proteinlerin çeşitliliği, farklı E3 enzimlerinin sayısına yansır. E3 enzimlerinin üç alt ailesine (HECT, RING ve U-Box) yapısal olarak ait olan tüm enzimler hesaba katılırsa, daha yüksek organizmalar için birkaç yüz ile bin arasında bir sayı varsayılabilir.
Her yerde bulunma türleri
Ubikuitinler, ilgili hedef proteine farklı yollarla bağlanabilir ve diğerleri, farklı noktalarda bağlanabilir. Bağlı ubikuitin moleküllerinin sayısına göre, tek bir molekül veya birkaç, birkaç veya birçok ubikuitin olmasına bağlı olarak, mono- ve oligo-, çoklu veya çoklu-her yerde bulunma arasında bir ayrım yapılır.
En az beş ubikuitin molekülü bir hedef proteine zincir olarak bağlanırsa, poli-ubikuitinasyondan söz edilir. Bu moleküller birbirine lizin 48'de (K48) bağlanırsa, hedef protein esas olarak proteazom tarafından parçalanır . Lizin 63'teki (K63) bağlantı , proteinin lizozomal bozulmasına yol açabilir . Ayrıca, bu modifikasyonun, DNA hasarının hücresel toleransı , enflamatuar immün yanıtlar, endositotik süreçler ve ribozomal protein sentezi üzerinde bir etkiye sahip olduğu gözlendi .
Öte yandan, tekli ve çoklu-her yerde bulunma, tek tek proteinlerin stabilitesini hücre içi dağılımlarından daha az etkiler ve diğer proteinlerle etkileşimi mümkün kılabilir. Örneğin oligo-her yerde bulunma, bozulmasını başlatmadan bir transkripsiyon faktörünün aktivitesini etkiler .
Ubiquitination örnekleri
Yanlış katlanmış proteinlerin parçalanması
Ubikuitin proteazom sistemi, hücre içi olarak üretilen proteinlerin "kalite güvencesinde" önemli bir rol oynar. Proteinlerin işleyebilmeleri için üretimleri sırasında ve sonrasında uygun şekilde katlanması gerekir . Bazı proteinlerin katlanması, üretilen proteinlerin% 60-80'inin yanlış katlandığı epitel hücrelerinde klorür iyon kanalı CFTR kadar karmaşık ve hataya açıktır . Bu yanlış katlanmış proteinler, belirli koşullar altında proteinin doğru katlanmasını teşvik edebilen enzimler olan şaperonlar tarafından bağlanır. "Onarılamaz" bir yanlış katlanma durumunda, yanlış katlanmış proteini poli-ubikitinleştiren ve böylece proteazom tarafından parçalanmayı mümkün kılan bir protein-şaperon-ubikuitin-E3 ligaz kompleksinin oluşumu gözlendi. Bu şekilde yapısal olarak dejenere olan proteinlerin ne sitosolik olarak ne de membranla ilişkili hücre süreçlerini etkilememesi sağlanır.
Bununla birlikte, iyon kanalı CFTR durumunda , kodlama DNA'sında , 508 (F508) konumundaki fenilalanin mutasyonunda yansıtılan bir mutasyon meydana gelirse , bu, tüm CFTR proteinlerinin poli-ubikitinasyonuna ve erken bozulmasına yol açar. üretilmiş. Sonuç, kistik fibrozun klinik tablosudur . Mutasyona uğramış iyon kanalı proteini düzgün çalışamasa da, erken parçalanır. Bu örnek, yapısal olarak yanlış proteinlerin ubikitin aracılı bozunmasının katı kontrol sisteminin, aslında olumlu bir etkiye sahip olduğunu, organizma üzerinde de olumsuz bir etkiye sahip olabileceğini göstermektedir.
Transkripsiyonun düzenlenmesi
İlk adım protein sentezi olan transkripsiyon . Burada DNA, bir transkribe içine RNA bir enzim kullanılarak, RNA polimerazı . İçin transkripsiyon başlangıcı , DNA yer alan bir takım polimeraz transkripsiyon faktörleri gerekli. DNA'nın transkripsiyon faktörleri ve polimeraz için erişilebilirliği, kalıcı olarak DNA'ya bağlı protein kompleksleri, histonlar tarafından düzenlenebilir. DNA'ya "sarılmış" histonlara nükleozom denir.
ARG1'in (argininosüksinat sentaz geni 1) transkripsiyonunu düzenleyen ubikitin bağlayıcı protein Rad6, fırıncı mayasında keşfedildi. Rad6'nın yokluğunda, transkripsiyon faktörleri ve polimeraz , ARG1 geninin önündeki promotere (bir düzenleyici DNA sekansı ) bağlanabilir ve transkripsiyonu başlatabilir. Rad6 varlığında, bir ubikuitin molekülünü bir histon alt birimi H2B'nin lizin K123'ü ile bağlar . Bu, komşu nükleozomda bir H3 histonunun modifikasyonlarına yol açar: Histon H3, lizin K4 ve K49'da metillenir. Sonuç olarak, destekleyici, hiçbir transkripsiyon faktörünün bağlanamayacağı şekilde hareketsiz hale getirilir . Bu genin susturulmasının bir sonucu olarak , ARG1 geni artık ifade edilmez ve argininosüksinat sentaz enzimi artık hücrede üretilmez.
Ek olarak, meyve sineğinden elde edilen histon H2A, tarif edilecek ilk ubikitine proteindi. Memelilerde, H2A ve H2B histonlarının her yerde bulunma durumu, transkripsiyonel olarak aktif kromatin , DNA'nın tamamı ve bununla ilişkili proteinler için ilk işaretçi oldu .
Sinyal iletiminin bir parçası olarak ubikitin
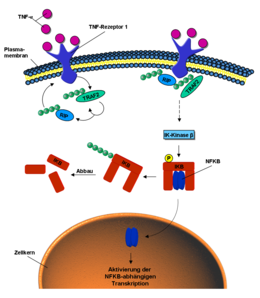
Ubikitin, NF-kB sinyal yolu ( engl. Nükleer faktör kappa B) gibi harici uyaranların hücre içi sinyal iletiminde rol oynar . Bu, sinyal molekülü tümör nekroz faktörü (TNF) ile aktive edilebilir . TNF , hücre zarının TNF reseptörüne bağlanırsa , konformasyonel değişimi , E3 ligaz TRAF2'yi reseptörün hücre içi kısmına dahil eder. Bu poli-ubikuitin kendisini ve RIP proteinini K63 bağlantıları yoluyla oluşturur. Ubiquitinated proteinler RIP ve TRAF2 , çeşitli kinazları , fosforile enzimleri aktive eder. Iκ kinaz β, nihayetinde IκB proteinini fosforile eder. Bu artık önceden bağlanmış ve etkin olmayan NF-κB'yi serbest bırakır. NF-KB içine göç hücre çekirdeği ve aktive orada belirli genlerin transkripsiyonunu. Öte yandan IkB, K48 yoluyla poli-ubikitine edilir ve proteazom yoluyla bozunur.
Daha fazla ubiquitination örnekleri
- Mitozun sona ermesinden sonra, hücre döngüsüne dahil olan siklin etiketlenir ve her yerde bulunma yoluyla parçalanır.
- Olarak , HIV enfeksiyonu, hücrenin bir anti-viral enzimler (ABOBEC3G) bir viral HIV proteini (Vif) ile bağlıdırlar. Vif aynı zamanda her yerde bulunma makinesinin parçalarını da bağlayabilir. Böylece Vif, APOBEC3G ile birlikte her yerde bulunur ve bozulur, böylece HIV enfeksiyonunun etkinliği artar.
- Multipotent kök hücrelerin farklılaşmasında artan mono-her yerde bulunma meydana gelir .
Hastalıklar
Angelman Sendromu u bir bir nörolojik hastalıktır .. yavaşlamış bilişsel ve motor gelişim yoluyla kendini ifade eder. En yaygın genetik kusur, maternal kromozom 15 gen lokusu q11-13 üzerindeki 4 milyon (MBp) baz çifti delesyonudur . Ancak bu bölge sadece hipokampta ve beyincikte aktiftir ve diğer şeylerin yanı sıra kodlar. E3 ubikuitin ligaz E6-AP için. Bu ligazdan yoksun fareler, örneğin korkunun koşullandırılmasında öğrenme eksiklikleri geliştirir . Ek olarak, farelerin uzun vadeli nöronal plastisitesi artık verilmemektedir. Bu eksiklikler kısmen Angelman sendromlu hastaların bozuklukları ile ilişkilidir.
- Hippel-Lindau'nun baskın olarak kalıtsal hastalığında , VHL ubikuitin ligaz genindeki bir mutasyon, transkripsiyon faktörü hipoksiye bağlı faktör (HIF) ve tümör gelişiminin birikmesine yol açar .
- Ubiquitin ligaz Parkin'deki mutasyonlar, Parkinson hastalığının belirli formlarında tanımlanmıştır .
- Mutasyonları Cullin7 ligaz ubikitin E3 neden olan otozomal - çekinik büyüme bozukluğu 3-M sendromu tespit edilmiştir.
Edebiyat
- Roland John Mayer, Aaron J. Ciechanover, Martin Rechsteiner: Protein Degradasyonu (= Ubiquitin-Proteazom Sistemi ve Hastalığı , Cilt 4), Wiley-VCH, Weinheim 2008, ISBN 978-3-527-31436-2 .
- P. Ebner, GA Versteeg, F. Ikeda: Bağışıklık tepkilerinin düzenlenmesinde Ubiquitin enzimleri. İçinde: Biyokimya ve Moleküler Biyolojide Eleştirel İncelemeler. Cilt 52, sayı 4, Ağustos 2017, s. 425-460, doi : 10.1080 / 10409238.2017.1325829 , PMID 28524749 , PMC 5490640 (ücretsiz tam metin) (inceleme).
- A. Varshavsky: Ubiquitin Sistemi, Otofaji ve Düzenlenmiş Protein Bozulması. In: Biyokimyanın yıllık incelemesi. Cilt 86, Haziran 2017, sayfa 123-128 , doi : 10.1146 / annurev-biochem-061516-044859 , PMID 28654326 (inceleme).
- PM Lombardi, MJ Matunis, C. Wolberger : DNA hasar tepkisinde RAP80, ubiquitin ve SUMO. İçinde: Moleküler tıp dergisi. Cilt 95, sayı 8, Ağustos 2017, s. 799-807, doi : 10.1007 / s00109-017-1561-1 , PMID 28681078 , PMC 5570449 (ücretsiz tam metin) (inceleme).
Bireysel kanıt
- ↑ MJ Pearce, J. Mintseris ve diğerleri: Mycobacterium tuberculosis'in proteazom yolunda yer alan Ubiquitin benzeri protein. İçinde: Bilim. Cilt 322, Sayı 5904, Kasım 2008, sayfa 1104-1107, doi : 10.1126 / science.1163885
- ↑ JA Maupin-Furlow: Prokaryotik ubikuitin benzeri protein modifikasyonu. In: Mikrobiyolojinin yıllık incelemesi. Cilt 68, 2014, s. 155-175, doi : 10.1146 / annurev-micro-091313-103447
- ↑ G. Goldstein, M. Scheid, U. Hammerling, D. Schlesinger, H. Niall, E. Boyse: Lenfosit farklılaştırıcı özelliklere sahip olan ve muhtemelen canlı hücrelerde evrensel olarak temsil edilen bir polipeptidin izolasyonu. İçinde: Proc Natl Acad Sci ABD . Cilt 72, No. 1, Ocak 1975, s. 11-5; doi: 10.1073 / pnas.72.1.11 , PMID 1078892 , PMC 432229 (ücretsiz tam metin).
- ↑ alınan bilgiler Nobel Vakfı Avram Hershko ve Irwin Rose 2004 ödül töreninde üzerinde (İngilizce)
- ↑ UniProt P62988
- ↑ Cecile M. Pickart, Shahri Raasi: Polyubiquitin Zincirlerinin Kontrollü Sentezi . In: Enzimolojide Yöntemler . Elsevier, 2005, ISBN 978-0-12-182804-2 , s. 21-36 , doi : 10.1016 / s0076-6879 (05) 99002-2 ( elsevier.com [27 Mayıs 2018'de erişildi]).
- ^ A b C. M. Pickart, MJ Eddins: Ubiquitin: yapılar, fonksiyonlar, mekanizmalar. İçinde: Biochim Biophys Açta . 1695 (1-3), 29 Kasım 2004, s.55-72. PMID 15571809 .
- ↑ CM Pickart: Her yerde bulunmanın altında yatan mekanizmalar. In: Annu Rev Biochem . 70, 2001, s. 503-533. PMID 11395416 .
- ↑ K. Cadwell, L. Coscoy: Bir viral E3 ubikuitin ligaz ile lizin olmayan kalıntılar üzerinde ubikitinasyon. İçinde: Bilim. 309 (5731), 1 Temmuz 2005, s. 127-130. PMID 15994556 .
- ↑ A. Ciechanover, R. Ben-Saadon: N-terminali ubikitinasyon: daha fazla protein substratı katılır. In: Trends Cell Biol . 14 (3), Mart 2004, sayfa 103-106. PMID 15055197 .
- ↑ D. Mukhopadhyay, H. Riezman: Endositoz ve sinyallemede ubikuitinin proteazomdan bağımsız fonksiyonları. İçinde: Bilim. 315 (5809), 12 Ocak 2007, s. 201-205. PMID 17218518 .
- ↑ A. Hershko, A. Ciechanover: Protein bozunması için ubikitin sistemi. In: Annu Rev Biochem. 61, 1992, s. 761-807. PMID 1323239 .
- ^ H. Barriere, C. Nemes, K. Du, GL Lukacs: Endozomal ayıklama makinesi tarafından lizozomal hedefleme sinyalleri olarak poliubikitin tanımanın plastisitesi. In: Mol Biol Hücresi. 18 (10), Ekim 2007, s. 3952-3965. PMID 17686993 .
- ↑ CM Pickart, D. Fushman: Polyubiquitin zincirleri: polimerik protein sinyalleri. İçinde: Curr Opin Chem Biol. 8 (6), Aralık 2004, sayfa 610-616. PMID 15556404 .
- ↑ S. Polo, S. Sigismund, M. Faretta, M. Guidi, MR Capua, G. Bossi, H. Chen, P. De Camilli, PP Di Fiore: Endositik proteinlerde ubikitin tanıma ve monobikitinasyondan sorumlu tek bir motif. İçinde: Doğa . 416 (6879), 28 Mart 2002, s. 451-455. PMID 11919637 .
- ↑ K. Flick, I. Ouni, JA Wohlschlegel, C. Capati, WH McDonald, JR Yates, P. Kaiser: Tek bir Lys 48 bağlantılı ubikuitin zinciri tarafından transkripsiyon faktörü Met4'ün proteolizden bağımsız regülasyonu. İçinde: Nat Celi Biol . 6 (7), Temmuz 2004, s. 634-641. 20 Haziran. PMID 15208638 .
- ^ A b C. Esser, S. Alberti, J. Höhfeld: Moleküler şaperonların ubikitin / proteazom sistemi ile işbirliği içinde : Biochim Biophys Açta. 1695 (1-3), 29 Kasım 2004, s. 171-188. PMID 15571814 .
- ↑ RR Kopito: CFTR'nin biyosentezi ve degradasyonu. In: Physiol Rev . 79 (1 Ek), Ocak 1999, s. 167-173. PMID 9922380 .
- ↑ CL Ward, S. Omura, RR Kopito: CFTR'nin ubikitin-proteazom yolu ile bozunması. İçinde: Hücre . 83 (1), 6 Ekim 1995, sayfa 121-127. PMID 7553863 .
- ↑ K. Robzyk, J. Recht, MA Osley: Mayada histon H2B'nin Rad6'ya bağımlı ubikitinasyonu. İçinde: Bilim. 287 (5452), 21 Ocak 2000, s. 501-504. PMID 10642555 .
- ↑ ZW Sun, CD Allis : Histon H2B'nin ortak kullanıma açık hale getirilmesi, mayada H3 metilasyonunu ve gen susturulmasını düzenler. İçinde: Doğa. 418 (6893), 4 Temmuz 2002, s.104-108. PMID 12077605 .
- ↑ IL Goldknopf, H. Busch: Histon olmayan ve kromozomal konjugat protein A24'ün histon 2 A polipeptitleri arasındaki izopeptit bağlantısı. İçinde: Proc Natl Acad Sci ABD . 74 (3), Mart 1977, s. 864-868. PMID 265581 .
- ^ LT Hunt, MO Dayhoff : ubikitinin amino terminal sekans özdeşliği ve nükleer protein A24'ün histon olmayan bileşeni. İçinde: Biochem Biophys Res Commun . 74 (2), 24 Ocak 1977, s. 650-655. PMID 836318 .
- ↑ SY Huang, MB Barnard, M. Xu, S. Matsui, SM Rose, WT Garrard: Aktif immünoglobulin kappa zincir geni, ubikuitin-konjuge olmayan nükleozomlar tarafından paketlenir. İçinde: Proc Natl Acad Sci U.S.A. 83 (11), Haziran 1986, sayfa 3738-3742. PMID 3012532 .
- ↑ M. Karin, Y. Ben-Neriah: Fosforilasyon, her yerde bulunmayı karşılar: NF- [kappa] B aktivitesinin kontrolü. In: Annu Rev Immunol . 18, 2000, s. 621-663. PMID 10837071 .
- ^ E. Meylan, J. Tschopp: RIP kinazları: hücresel stresin önemli entegratörleri. In: Trends Biochem Sci . 30 (3), Mart 2005, s. 151-159. PMID 15752987 .
- ^ TD Gilmore: NF-kappaB'ye Giriş: oyuncular, yollar, perspektifler. İçinde: Onkogen . 25 (51), 30 Ekim 2006, sayfa 6680-6884. PMID 17072321 .
- ↑ M. Magnani, R. Crinelli, M. Bianchi, A. Antonelli: Ubiquitin bağımlı proteolitik sistem ve nükleer faktör-kB (NF-kB) modülasyonu için diğer potansiyel hedefler. In: Curr İlaç Hedefleri . 1 (4), Aralık 2000, sayfa 387-399. PMID 11467077 .
- ^ F. Bassermann, C. von Klitzing, S. Münch, RY Bai, H. Kawaguchi, SW Morris, C. Peschel, J. Duyster: NIPA, mitotik girişi düzenleyen bir SCF tipi memeli E3 ligazını tanımlar. İçinde: Hücre. 122 (1), 15 Temmuz 2005, s. 45-57. PMID 16009132 .
- ^ Y. Dang, LM Siew, YH Zheng: APOBEC3G, poliubikitillenmeden Vif'e bağımlı bir şekilde proteazomal yolla bozulur. İçinde: J Biol Chem . 6 Mart 2008. PMID 18326044 .
- ↑ O. Karpiuk, Z. Najafova, F. Kramer, M. Hennion, C. Galonsk, A. König, N. Snaidero, T. Vogel, TA Shchebet, Y. Begus-Nahrmann, M. Kassem, M. Simons, H. Shcherbata, T. Beissbarth, SA Johnsen: Histon H2B monobikitinasyon düzenleyici yolu, çok potansiyelli kök hücrelerin farklılaşması için gereklidir. In: Moleküler Hücre. 46 (5), 2002, s. 705-713.
- ↑ E. Weeber, J. Levenson, J. Sweatt: İnsan bilişinin moleküler genetiği . In: Mol Interv . bant 2 , hayır. 6 , 2002, s. 376-391, 339 , doi : 10.1124 / mi . 2.6.376 , PMID 14993414 .
- ↑ H. Shimura, N. Hattori, S. Kubo, Y. Mizuno, S. Asakawa, S. Minoshima, N. Shimizu, K. Iwai, T. Chiba, K. Tanaka, T. Suzuki: Familial Parkinson hastalığı gen ürünü parkin, bir ubikitin protein ligazdır. İçinde: Nat Genet . 25 (3), Temmuz 2000, s. 302-305. PMID 10888878 .
- ↑ C. Huber, D. Dias-Santagata, A. Glaser, J. O'Sullivan, R. Brauner, K. Wu, X. Xu, K. Pearce, R. Wang, ML Uzielli, N. Dagoneau, W. Chemaitilly, A. Superti-Furga, H. Dos Santos, A. Mégarbané, G. Morin, G. Gillessen-Kaesbach, R. Hennekam, I. Van der Burgt, GC Black, PE Clayton, A. Read, M. Le Merrer, PJ Scambler, A. Munnich, ZQ Pan, R. Winter, V. Cormier-Daire: 3-M sendromunda CUL7'deki mutasyonların tanımlanması. İçinde: Nat Genet. 37 (10), Ekim 2005, s. 1119-1124. PMID 16142236 .
İnternet linkleri
- Protein Modifikasyonu ve Bozulması için Ubikitin Sistemi. Nottingham Üniversitesi'nde Ubiquitin hakkında bilgiler.
- Jennifer McDowall: Ubiquitin. (İngilizce).