Kistik fibrozis
| ICD-10'a göre sınıflandırma | |
|---|---|
| E84 | Kistik fibrozis |
| E84.0 | Pulmoner bulguları olan kistik fibroz |
| E84.1 | Bağırsak belirtileri olan kistik fibroz |
| E84.8 | Diğer belirtilerle birlikte kistik fibroz |
| E84.9 | Kistik fibroz, tanımlanmamış |
| ICD-10 çevrimiçi (WHO sürümü 2019) | |
Kistik fibrozis (türetilmiş latin mukus , balgam 've viscidus sert' veya ' yapışkan ') ve sistik fibroz ( İngilizce kistik fibroz , CF ), bir olan otozomal - çekinik kalıtsal metabolik bir hastalıktır .
Bu hastalığın nedeni, tüm ekzokrin bezi salgılarının bileşimini değiştiren Kistik Fibrozis Transmembran İletkenlik Düzenleyicisi (CFTR) olan belirli vücut hücrelerinin klorür kanallarının mutasyona bağlı bir arızasıdır . Etkilenen hücreler mümkün değildir çevreleyen dokuya su çekmek yoluyla ozmoz su içeriğini arttırır, bronşiyal sekresyon ve salgıları pankreas , karaciğer ( safra ), iç genital organlar ve yardımcı cinsiyet bezleri oyuk olarak çünkü ince bağırsak ve ter bezleri düşüktür. Sonuç olarak salgılar viskoz hale gelir ve etkilenen organlarda çeşitli tipte fonksiyonel bozukluklar meydana gelebilir.
Bu nedenle kistik fibroz çok sistemli bir hastalıktır . Etkilenenlerde farklı kistik fibrozis formlarına yol açabilen 2000'den fazla farklı mutasyon bilinmektedir. Kistik fibroz, açık tenli popülasyonda en sık görülen otozomal resesif kalıtsal hastalık ve en yaygın ölümcül genetik hastalıktır. İstatistiksel olarak bu nüfus grubunda her 2000 canlı doğumda bir hasta çocuk düşmektedir . Hastalığın sıklığında önemli bölgesel dalgalanmalar vardır.
İlk belirtiler erken çocukluk döneminde ortaya çıkar. Kistik fibroz doğum öncesi teşhis edilebilir. Ölümcül hastalık şu anda tedavi edilemez . Tıbbi ilerleme, son birkaç on yılda yeni tedavi seçenekleri oluşturmayı mümkün kıldı ve bu sayede ortalama yaşam beklentisi artık önemli ölçüde 40 yıla çıkarıldı. Yeni, kişiselleştirilmiş tedavi konseptleri ile gelecekte yaşam beklentisinde daha fazla iyileşme beklenebilir. Hastalık yoğun araştırmaların konusudur.
İki terim kistik fibroz ve kistik fibroz , aynı hastalığın farklı semptomlarını tanımlar. Almanca konuşulan ülkelerde - İngilizce konuşulan ülkelerin aksine - kistik fibroz terimi tercih edilir.
epidemiyoloji
Avrupa'da kistik fibrozlu bir çocuğa sahip olma şansı 2000'de 1 civarındadır. Şu anda Almanya'da kistik fibrozdan muzdarip yaklaşık 8.000 kişi var. Dünya çapında, her biri 30.000'i Avrupa ve Kuzey Amerika'da olmak üzere toplam 70.000 civarında vardır. Almanya'da her yıl yaklaşık 300 kistik fibrozlu çocuk doğuyor. Kistik fibroz, 15 yaşına kadar olan çocuklarda ölüme yol açan kalıtsal hastalıkların ilkiydi.
| mutasyon | Gen segmenti | mutasyon türü | sınıf | D [%] | bir [%] | CH [%] |
| ΔF508 | Ekson 10 | Amino asit silme | II | 71.8 | 62.9 | 64.1 |
| R553X | Ekson 11 | Mutasyonu durdur | BEN. | 2.0 | 1.7 | 3.5 |
| N1303K | Ekson 21 | amino asit ikamesi | II | 1.8 | 0,6 | 1.6 |
| R347P | Ekson 7 | amino asit ikamesi | IV | 1.2 | 1.6 | 0,8 |
| G542X | Ekson 11 | Mutasyonu durdur | BEN. | 1.2 | 3.3 | 1.6 |
| G551D | Ekson 11 | amino asit ikamesi | III | 0.9 | 1.2 | 0,2 |
| 1717 1G → Bir | intron 10 | ek mutasyonu | BEN. | 0.9 | 0,8 | 3.8 |
| 2789 + 5G → Bir | intron 14b | ek mutasyonu | IV | 0.9 | 2.4 | 0,3 |
| 3905insT | Ekson 20 | çerçeve kayması mutasyonu | BEN. | - | - | 4.8 |
Alel sıklığı Alman nüfusundaki 0,025 yaklaşık 0.02 olduğunu. Bu sayı, bir popülasyondaki bir alelin nispi bolluğunun bir ölçüsüdür . Bunu, popülasyonun yaklaşık %4'ünün, yani her yirmi beşte birinin kusurlu bir CFTR geni taşıdığını takip eder . Yalnızca Almanya'daki bu kabaca üç milyon insan (istisnalar dışında) mutasyona uğramış aleli aktarabilen sağlıklı gen taşıyıcılarıdır. Bu durumda, heterozigot özellik taşıyıcılarından söz edilir. Özelliğin iki heterozigot taşıyıcısının bir çocuk sahibi olma olasılığı, toplam popülasyona dayalı olarak 0.02² = 0.0004 olasılığına sahiptir. 81,2 milyonluk bir nüfusla (Aralık 2014 itibariyle, Federal İstatistik Ofisi), bu matematiksel olarak 32.000 nüfusa karşılık gelir. Epidemiyolojik çalışmalarda Almanya için 1:3,300 değeri belirlenmiştir. Dünya çapında bakıldığında , kistik fibroz insidansı çok farklıdır. İrlanda , 1800'de 1 ile dünya çapında kistik fibrozlu bir çocuğa sahip olma olasılığının en yüksek olduğu ülkedir. Finlandiya , 1: 25.000 ile Avrupa'daki en düşük değere sahiptir . Afrika kökenli insanlar için risk 17.000'de 1'dir. Asya kökenli insanların, 100.000'de 1 civarında bir durumla doğması pek olası değildir. Örneğin, Japonya'daki değer 1: 350.000'dir.
CFTR genindeki farklı mutasyonlar şu anda 2019'da (Haziran 2017 itibariyle) istatistiksel olarak kaydedilmektedir. Bu mutasyonlar popülasyon boyunca eşit olmayan bir şekilde dağılmıştır. 20'den az mutasyon %0.1'den fazlasını oluşturur ve sadece beş mutasyon toplam kistik fibroz hastalıklarının %1'inden fazlasını oluşturur. Açık farkla en yaygın mutasyon ΔF508 olarak adlandırılır . Kistik fibroz hastalarında tüm CFTR alellerinin yaklaşık 2/ 3'ünde bulunur. Avrupa'da prevalans kuzeybatıdan güneydoğuya doğru azalmaktadır .
2019 kayıtlı mutasyonlar arasında, eşanlamlı olmayan mutasyonlar , yani nokta mutasyonları , farklı bir amino asit için kod bu kısmını oluşturan % 39.4 ile. Bunu %15,7 ile DNA üzerindeki CFTR'nin okuma çerçevesindeki kaymalar olan çerçeve kayması mutasyonları ve %11.3 ile ek mutasyonları izlemektedir . Anlamsız mutasyonların oranı %8.4, çerçeve içi silme ve çerçeve içi eklemelerin oranı %2.1'dir. Büyük eklemeler ve silmelerin sıklığı %2,6'dır. Promotör mutasyonlar CFTR olan gen, promotör bölgede nokta mutasyonları CFTR azaltılmış yol, gen ekspresyonunun bir CFTR ,% 0.74 bir bölümü ile nispeten nadirdir. CFTR'nin kodlama bölgelerinde tespit edilen mutasyonların sadece %13.3'ü hastalığa yol açmaz . %6.5'inde mutasyonun tipi hala bilinmemektedir.
Kurucu etki nedeniyle , bazı oldukça nadir mutasyonlar, bazı popülasyonlarda önemli ölçüde aşırı temsil edilebilir. Kurucu etki, dini, etnik veya coğrafi izolasyondan kaynaklanabilir. Örneğin, W1282X stop mutasyonu Aşkenazi Yahudilerinde , 394delTT delesyonu İskandinav halklarında , 3905InsT insersiyonu İsviçre'de, S549R amino asit substitüsyonu Bedevilerde ve 3120+1G → A ek mutasyonu Afrika kıtasında kistik fibrozda nispeten sık görülür. hastalar. 3905InsT mutasyonu özel bir durumdur. Sadece İsviçre'de, Kuzey Amerika'daki Amish topluluğunda ve Acadians'ta yaygındır . İsviçre'de CFTR mutasyonları arasında %4.8'lik bir sıklık ile ikinci sırada yer almaktadır . Amish ile %16,7 ve Acadians ile %14,3'lük bir değere bile ulaşılmaktadır. Bunun nedeni , 18. yüzyılda Amish topluluğunu kuran ve aynı zamanda Louisiana'ya yerleşen Almanca konuşan İsviçre'den gelen göçmenlerin kurucu etkisidir . Almanya'da, ΔF508 mutasyonu hastaların %72'sinde bulunur, ancak kalan %28'lik son derece heterojen ve çeşitli bir spektruma sahiptir ve bu da genetik tanıyı zorlaştırır. Alman kistik fibroz hastalarında şimdiye kadar 80'den fazla farklı mutasyon tespit edilmiştir. Mutasyon formu hastalığın seyrini ve giderek artan bir şekilde tedavi seçeneklerini etkilediğinden, CFTR genindeki nispeten nadir mutasyon formları ile klinik prognozu belirlemek genellikle zordur. Çok az hasta var ve bu nedenle aynı CFTR genotipine sahip neredeyse hiç vaka çalışması yok . 1995 yılında bilinen mutasyonlardan yaklaşık üçte biri o kadar nadirdir ki bugüne kadar sadece tek bir ailede bulunmuştur ( özel mutasyon ). Spontan mutasyonlar son derece nadirdir. Şimdiye kadar, dünya çapında sadece dört vaka tanımlanmıştır.
Genetik ve moleküler biyoloji
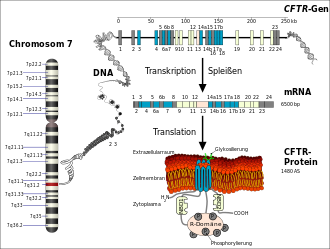
Kistik fibrozis nedeni farklı mutasyonları olan CFTR - genini o uzun kolu üzerinde insanlarda kromozomun 7 ( lokus oturan q31.2). CFTR gen kodları için protein Kistik fibroz membran geçirgenliğinin Regülatör (CFTR). Bu gen ürünü , hücre zarında bir klorür kanalı olarak işlev görür. Gendeki değişiklik proteini de değiştirir ve kanal işlevi ya yoktur ya da sınırlıdır. Bu nedenle, etkilenen proteinde fonksiyon kaybına yol açan bir mutasyondur ( fonksiyon kaybı mutasyonu ). Bu gendeki en yaygın mutasyona ΔF508 denir. ΔF508 , CFTR proteininde 508 konumunda amino asit fenilalanin (tek harfli kodda 'F') yokluğunu belirtir ve kistik fibrozlu on kişiden yaklaşık yedisini etkiler.
Şimdiye kadar, farklı popülasyonlarda az ya da çok sıklıkla meydana gelen CFTR geninin 2000'den fazla farklı mutasyonu bilinmektedir. Özel bir özellik, kistik fibrozda, CFTR geninin iki farklı mutasyonunun , yani aynı genin iki farklı alelinin yine de hastalığa yol açabilmesidir. Otozomal çekinik kalıtımın bu özel takımyıldızına bileşik heterozigotluk denir.
Kistik fibroz otozomal resesif bir şekilde kalıtıldığı için, hastalık sadece özelliğin taşıyıcısı her iki ebeveynden de mutasyona uğramış bir geni miras alırsa ortaya çıkar. Her iki ebeveyn de bir mutasyona uğramış ve bir değişmemiş genin taşıyıcılarıysa, bir çocuğun iki bozulmamış gen kopyası alma olasılığı %25'tir. Bozulmamış ve mutasyona uğramış bir kopyası olan çocuğun sağlıklı olması ancak mutasyonu geçirebilme olasılığı %50'dir ve çocuğun hastalanma, yani hastalığa neden olan varyantı her iki ebeveynden miras alma olasılığı da %25'tir. Her iki ebeveyn de hastaysa, tüm çocuklar hastalığı miras alır. Bununla birlikte, etkilenenler çoğunlukla kısır olduğu için bu pek olası değildir.
patoloji

1480 amino asitten oluşan CFTR proteini, endoplazmik retikulumdaki endotel hücreleri tarafından dokuz ila on dakika içinde sentezlenir. Katlama son derece karmaşık protein 30-120 dakika sürer. Katlama işlemi, Hsp70 , Hsp40 , Hsp90 ve Calnexin gibi bir dizi şaperon tarafından desteklenmektedir . Bu periyottaki protein doğru bir şekilde öne katlanmazsa, o zaman ubr1'in işe aldığı Hsp70 gibi şaperonlar olacaktır , yanlış katlanmış CFTR ubiquitinyliert ve dolayısıyla 26S proteazom tedarikindeki azalma . Bu protein kalite kontrolü , işleyen bir proteomun sürdürülmesi ve hücrenin hayatta kalması için temel öneme sahip hücresel koruyucu bir mekanizmadır. Proteazomdaki bozunmaya ve - CFTR durumunda - hücre zarına taşınmaya karar veren kriter , proteinin azaltılmış bir işlevi değil, önemli ölçüde azaltılmış katlanma kinetiğidir. Muhtemelen, proteinin yeterli zamanı olsaydı, yine de doğru şekilde katlanırdı. Aslında, sağlıklı homozigot insanlarda CFTR proteinlerinin yaklaşık %75'i, protein kalite kontrolü tarafından "yanlış" katlanmış olarak tanınır ve parçalanır.
CFTR proteini, hücre zarı üzerinde bulunan ve esas olarak epitel hücreleri tarafından eksprese edilen siklik adenosin monofosfat (cAMP) tarafından düzenlenen bir klorür kanalıdır . Mutasyona bağlı olarak, klorür kanalının ekspresyonu baskılanabilir veya hücre zarında yalnızca kusurlu CFTR proteinleri veya sınırlı bir işlevi veya süresi olan CFTR proteinleri vardır. CFTR'nin başarısızlığı, epitel hücrelerinin CFTR'yi eksprese ettiği tüm organlarda trans-epitelyal taşımanın bozulmasına yol açar. Bunlar öncelikle solunum yolu , pankreas, ince bağırsak, erkek üreme organları ve deridir. Bu nedenle kistik fibroz çok sistemli bir hastalıktır. CFTR'nin başarısızlığı, esas olarak pulmoner epitel üzerinde olumsuz etkilere sahiptir. Sağlıklı insanlarda bu, nefese bakan tarafta yaklaşık 5 µm kalınlığında Havayolu Yüzey Sıvısı (ASL) ile kaplıdır . Bu katman, ince bir sıvı soldan oluşur ve kirpiklerin uzunluğundan (yaklaşık 6 ila 7 µm) biraz daha az kalındır. Jel oluşturan yapışkan müsinler ASL üzerinde yüzer . Sağlıklı insanlarda bu jel bir ila birkaç milimetre kalınlığa sahiptir. Solunan patojenlere karşı ilk savunma hattını temsil eder ve mukosiliyer klirensin temel bir bileşenidir . Bu savunma hattı, kistik fibrozlu hastalarda hasar görür.
CFTR'deki genetik kusurun neden mukosiliyer klirensin bozulmasına yol açtığına dair iki farklı hipotez vardır . Her ikisi de birincil kusurun iyon alımında CFTR'nin işlevsizliği olduğu varsayımına dayanmaktadır. Yüksek tuzlu hipotezi epitel nedeniyle artık CFTR kusur bırakmaya yetecek kadar sodyum klorür absorbe olduğunu varsayar. Bu , ASL'de artan bir ortak tuz konsantrasyonuna ( yüksek tuz ) yol açar ve bu da β- defensin gibi salgılanan antimikrobiyal peptitlerin etkisini ciddi şekilde sınırlar . Düşük hacimli hipoteze göre ise ASL'deki ve plazmadaki sodyum klorür konsantrasyonu aynıdır. Bununla birlikte, CFTR'nin başarısızlığının, epitelyal sodyum kanallarının (ENaC) ekspresyonunun artmasına yol açtığı ve bunun da hücre içine sodyum iyonlarının daha fazla taşınmasıyla sonuçlandığı söylenmektedir. Ozmotik basıncı eşitlemek için, su molekülleri daha sonra bazolateral taraftan epitele akar ve bu da ASL'nin hacminde ( düşük hacim ) bir azalmaya yol açar . Daha ince ASL, mukusun patojenlerle kolonizasyonunu kolaylaştıran ciddi şekilde kısıtlanmış bir mukusiliyer klirense neden olur. Her iki hipotez de 1990'ların sonunda ortaya çıktı ve uzun süre tartışmalı olarak tartışıldı. Her iki hipotezden de farklı, birbiriyle çelişen tedavi seçenekleri türetilebilir. Düşük hacimli hipoteze göre, ASL'ye su eklemek iyileşmeye yol açmalıdır, yüksek tuz hipotezine göre ise ASL'den sofra tuzunu çıkarmak daha iyi bir strateji olacaktır.
Fizyolojik olarak, CFTR proteini, hücre zarındaki bir klorür kanalından daha fazlasıdır. Epitelyal sodyum kanallarının ekspresyonu üzerinde yukarıda bahsedilen etkiye ek olarak, CFTR ayrıca Dışa Doğru Rektifiye Klorür Kanallarını ( ORCC ) ve Renal Dış Medüller Potasyum Kanalını ( ROMK ) da düzenler . Ek olarak, klorür-bağlı hidrojen karbonat taşınması ve sfingolipidlerin alımı CFTR'den etkilenir.
mutasyon sınıfları
Kistik fibrozise neden olan yaklaşık 2000 mutasyon, patomekanizmalarında farklılık gösteren altı sınıfa ayrılabilir. Bazı mutasyonlar, CFTR proteininin sentezinin neredeyse tamamen başarısız olmasına yol açar. Diğerlerinde, örneğin, proteinin hücre zarına dahil edilmesi engellenir veya proteinin iyon kanalı bloke edilir veya yalnızca sınırlı bir ölçüde iletkendir. ΔF508 mutasyonuna sahip homozigot hasta grubu dışında, diğer hasta grupları nispeten küçüktür. Belirli bir fenotipe belirli bir genotip atamayı amaçlayan genom çapında ilişkilendirme çalışmaları (GWAS), bu nedenle yalnızca birkaç, sık görülen CFTR mutasyon tipi için mümkündür . Temel olarak, homozigot ve bileşik-heterozigot CFTR varyantlarının dikkate alınması gereken birçok farklı genotip, farklı hastalık seyri, şiddet dereceleri ve nihayetinde yaşam beklentileri ile çok sayıda farklı fenotipe yol açar.
Sınıflandırma her zaman patomekanizma ile tutarlı değildir, ancak bazen fenotipe dayanır. A455E mutasyonu, örneğin sınıf V'ye atanır. ΔF508 ile karşılaştırıldığında, daha hafif bir kistik fibrozis formuna yol açar. Ancak 2014'te bir çalışma grubu, bu mutasyonla proteazomdaki proteinin büyük bir bölümünün aslında parçalandığını, bu da - ΔF508 durumunda olduğu gibi - bir sınıf II mutasyona karşılık geldiğini buldu. ΔF508 ile arasındaki tek fark, A455E'nin daha küçük bir oranının proteazomda parçalanmasıdır, bu da sonuçta bu mutasyonda kistik fibrozun daha hafif tezahürüne yol açar.
- Sınıf I.
Sınıf I mutasyonlar söz konusu olduğunda, genetik kusur o kadar şiddetlidir ki CFTR proteini üretilmez. Bunun nedeni , transkripsiyon sırasında kararsız bir mRNA'ya yol açan erken durdurma kodonları (durdurma mutasyonları) olabilir . R1162X hariç tüm durdurma mutasyonları sınıf I'e aittir. Anlamsız aracılı mRNA bozunması (NMD), mRNA'daki erken durdurma kodonlarını tanıyan ve bunların kısaltılmış proteinler olarak ekspresyonunu önleyen bir hücresel kontrol mekanizmasıdır . Sınıf I mutasyonlarının örnekleri Gly542X, Trp1282X ve Arg553X'tir. Diğer bir neden, 621 + 1G → T gibi kanonik ek mutasyonları ve CFTR del2,3 gibi kromozomal delesyonlar olabilir ve bu da endoplazmik retikulumda CFTR üretiminin kaybına yol açar . Tüm kistik fibroz hastalarının yaklaşık %5 ila %10'u sınıf I mutasyonlara sahiptir.
- Sınıf II
Protein sentezi, sınıf II mutasyonlarda gerçekleşir, ancak CFTR genindeki bir mutasyon nedeniyle , CFTR proteininin birincil yapısı yanlıştır. Bu , proteinin üçüncül yapısını etkiler, protein yanlış katlanır. Bu protein yanlış katlanması , hücrenin protein kalite kontrolü tarafından tanınır, protein her yerde bulunur, proteazoma taşınır ve orada parçalanır. Dünyanın en yaygın CFTR mutasyonu ΔF508 ile Asn1303Lys, Ile507del, Arg560Thr ve Gly85Glu mutasyonları bu sınıfa aittir.
- Sınıf III
Sınıf III mutasyonlar durumunda, CFTR proteini üretilir ve hücre zarı üzerinde de eksprese edilir. Ancak klorür kanalı açılamadığından işlevsel değildir. Bu sınıfın örnekleri, Gly551Asp, Gly178Arg, Gly551Ser ve Ser549Asn mutasyonlarıdır. Almanya'da, kistik fibroz hastalarının yaklaşık %3'ü bu mutasyon sınıfına atanabilir.
- Sınıf IV
Sınıf IV mutasyonlarda bile, CFTR hücre zarında ifade edilir. Klorür kanalı açılabilir, ancak klorür iyonları için geçirgenliği ciddi şekilde sınırlıdır. Örneğin, Arg117His, Arg347Pro, Arg117Cys ve Arg334Trp mutasyonlarında durum budur.
- Sınıf V
Sınıf V mutasyonlar durumunda, çok az CFTR proteini üretilir. Bunun nedeni çoğunlukla alternatif eklemeye yol açan ve dolayısıyla üretilen CFTR proteini miktarı üzerinde doğrudan olumsuz bir etkiye sahip olan intronlardaki mutasyonlardır . Örnekler 3849 + 10kbC → T, 2789 + 5G → A ve 5T mutasyonlarıdır.
- sınıf VI
Mutasyon sınıfı VI nispeten nadirdir. Fonksiyonel CFTR proteini hücre zarında eksprese edilir, ancak proteinin hücre zarı üzerindeki stabilitesi azalır, böylece sitoplazmaya döner ve nispeten hızlı bir şekilde parçalanır. Bunun bir örneği 4326delTC mutasyonudur. Yabani tiple karşılaştırıldığında , bu gen ürünü 5 ila 6 kat daha yüksek bir bozunma oranına sahiptir.
Klinik tablo
Mutasyonun türüne bağlı olarak, hastalığın semptomları az ya da çok belirgindir. Hastanın her iki kromozomda CFTR genlerinin farklı mutasyonları varsa , sadece daha az kusurun semptomları gelişecektir. Daha az bozulmaya neden olan mutasyonlara sahip kişiler genellikle yalnızca pankreas ile ilgili sorunlar yaşarlar ; ciddi mutasyonlar, belirtilen tüm semptomları yaşayabilir .
Solunum sistemi
Kistik fibroz hastalarında bronşlardaki mukus , sağlıklı insanlara göre önemli ölçüde daha viskozdur. Bu, kronik öksürük , bronşektazi , sıklıkla tekrarlayan akciğer enfeksiyonları ve şiddetli pnömoniye yol açar . Zor salgı olabilir ancak zorlukla kaldırılacak tarafından kirpikli epiteli trake ve bronşlarda. Bu nedenle , özellikle hastalığın ilk birkaç yılında Haemophilus influenzae ve Staphylococcus aureus gibi patojenler için iyi bir besin ortamıdır ve daha sonraki süreçte Pseudomonas aeruginosa , Burkholderiacepacia kompleksi (anlam: Burkholderia cepacia , B. cenocepacia ve B. multivorans), Stenotrophomonas maltophilia ve "kara maya" ( Exophiala dermatitidis ve Exophiala phaeomuriformis ) Etkilenenler genellikle aspergillozdan muzdariptir . 21. yüzyılın başında , solunum yollarından Inquilinus limosus, Ralstonia türleri ve Pandoraea'nın yanı sıra çoklu dirençli gram negatif çubuklar ve tüberküloz olmayan mikobakterilerin tespitinde de bir artış oldu . Sık ve uzun süreli akciğer enfeksiyonlarının bir sonucu, kronik oksijen eksikliği ve nefes darlığı olarak fark edilen artan akciğer yetmezliği olabilir . Kronik oksijen eksikliği nedeniyle, etkilenen insanların çoğunda saat camı çivileri ve baget parmakları vardır . Son dönem kronik endobronşiyal enfeksiyonlar, kistlere , trakeal divertiküllere , apselere ve pulmoner fibrozise , yani kistik fibroz hastalarında genellikle erken mortalitenin nedeni olan hava yollarının geniş ölçüde tahrip olmasına yol açar . Hastaların %90'ından fazlası kronik alt solunum yolu enfeksiyonlarının bir sonucu olarak ölmektedir.
Oksidatif stres , akciğerlerde CFTR ekspresyonunu azaltır. Sağlıklı sigara içenlerde, sağlıklı sigara içmeyenlere kıyasla, akciğerlerde CFTR'nin daha düşük değerlerinin belirtileri bulunabilir. Buna karşılık, endojen bir antioksidan olan glutatyon kullanılarak oksidatif stres azaltılabilir. Akciğerleri oksidatif stresten korumada önemli bir işlevi vardır. Enzim glutamat sistein ligaz etkiler hücrelerde glutatyon sentezi. Bir polimorfizmi GCLC olan gen glutamat sistein ligazı kodlayan akciğerlerde glutatyon artan üretimine yol açabilir. 2006 yılındaki bir çalışmada, GCLC polimorfizminin klinik tablo üzerindeki olası etkisi için 440 kistik fibroz hastası incelendi. Hafif formda bir CFTR genotipi olan hastalarda GCLC'nin fonksiyonel polimorfizmi ile kistik fibrozun şiddeti arasında anlamlı bir ilişki bulundu .
Sindirim kanalı
Bebeklerde, bağırsakta vakaların %10 ila %20'sinde bir mekonyum ileusu oluşur . Bu, sert ilk dışkının (mekonyum) neden olduğu ciddi bir bağırsak tıkanıklığıdır ( ileus ) - genellikle kistik fibrozun ilk belirtisidir . Yaşlılarda, %20 oranında viskoz bağırsak salgılarına bağlı tıkanıklık sendromları bulunur . Bu, bireysel vakalarda mekonyum ileus eşdeğeri olarak adlandırılan komplikasyonlara yol açabilir. Tekrarlayan karın ağrısı, elle hissedilen bağırsak içeriği ve bağırsak tıkanıklığı ( obturatio intestini ) ile kendini gösterir. Bu semptomlara kusma eşlik eder.
Pankreasın işlevi de bozulur. Salgılama eksikliği, kronik diyare, neden yağlı dışkı , sindirim bozukluğu , kötü beslenme ve sindirim bozuklukları gibi olmak kilolu . Pankreasın artan fibrozu, Langerhans adacıklarının batmasına yol açar ve bu da pankreatojenik diyabetes mellitusa yol açabilir . Bu vakalar, tip 3 diabetes mellitus olarak sınıflandırılan CF ile ilişkili diyabet (CFRD) olarak adlandırılır.
19 yaşın üzerindeki hastaların yaklaşık %75'inde bozulmuş glukoz toleransı vardır. Çocuklarda bile diabetes mellitus (diyabet) riski aynı yaştaki sağlıklı çocuklara göre 10 kat daha fazladır. Risk yaşla birlikte artar. Genellikle , anabolik etkisi ile hastanın güçlenmesine de katkıda bulunan erken bir insülin uygulaması önerilir.
Etkilenen yetişkinler, bozulmuş karaciğer ve safra yolu işlevi nedeniyle karaciğer sirozu ve safra taşlarına eğilimlidir . Hastaların %5.6'sında siroz gelişir ve %25'e varan oranda safra taşı gelişir.
İskelet sistemi

Son on yılda kistik fibroz hastalarında sağkalım oranında elde edilen önemli gelişmeler, osteoporoz dahil olmak üzere geç komplikasyon insidansının artmasına neden olmuştur . Kistik fibrozlu tüm yetişkin hastaların yaklaşık üçte biri de osteoporoza sahiptir. Bu hastalarda kemik yoğunluğu önemli ölçüde azalmıştır. Bu, kırık riskini ve kifoz ("kambur") gelişimini artırır . Erişkin kistik fibroz hastalarında kaburga kırıkları sağlıklı bir karşılaştırma grubuna göre 10 ila 100 kat daha yaygındır.
Kemik yoğunluğunun azalmasının kesin nedenleri henüz yeterince araştırılmamıştır. Açıkçası, birkaç patomekanizmanın çok karmaşık bir etkileşimidir. Kötü beslenme durumu, emilim ve vitamin D ve K , hem de indirgenmiş bir kalsiyum ve serumda fosfat içeriği oyun önemli bir rol . Çalışmalar ayrıca enfeksiyon evrelerinde kemik erimesinin (kemik yıkımı) arttığını ve kemik oluşumunda bozulmaların gözlenebildiğini göstermiştir. Bu aşamalarda, kemik kaybından sorumlu osteoklastların sayısı önemli ölçüde artar. Son araştırmalar ayrıca, CFTR proteininin bozulmuş fonksiyonunun, kemik oluşumundan sorumlu osteoblastların işlev bozukluğuna yol açtığını ileri sürmektedir . Osteoblastlar CFTR'yi ifade eder. Arasındaki denge bozukluklarına açıkça osteoblastlar uçları klorid kanalının olmaması osteoprotegerin ve prostaglandin 2 . Solunum durumunu iyileştirmek için özellikle glukokortikoidler olmak üzere ilaçların uzun süreli kullanımı da kemik kaybını teşvik edebilir. Bu, özellikle akciğer nakli geçirmiş kistik fibroz hastalarında geçerlidir. Akut fazda organ reddini bastırmak için önce yüksek dozlarda, sonra düşük dozlarda glukokortikoid alırsınız.
Üreme organları
Çoğu durumda, hasta erkekler kısırdır . Sperm normal olarak oluşmasına rağmen, her iki tarafta da vas deferens yoktur. Bu, vas deferens'in konjenital bilateral aplazisi olarak bilinir (vas deferens'in konjenital bilateral aplazisi için CBAVD ). CBAVD, etkilenen erkeklerin %75 ila 80'inin CFTR geninde mutasyonlar taşıdığı bağımsız bir klinik tablodur . Etkilenenler, kistik fibrozun diğer tüm semptomlarından yoksun olabilir. Bu tür vakalar, hafif bir özel kistik fibroz şekli olarak görülebilir. Özel bir mutasyon spektrumu, özellikle 5T aleli, hafif ifadeden sorumludur. CAVD'li erkeklerin %70 ila 80'i CFTR geninde iki mutasyona sahiptir; bunlardan biri, örneğin sadece bir transmembran bölgesinde amino asit değişikliğine neden olan hafif bir aleldir .
Kadınlarda servikal kanaldaki viskoz salgılar doğurganlığı azaltır. Hastaların yaklaşık %50'si hamile kalabilir. Genel durum stabil ise, kistik fibroz hastalarının terme kadar gebelik taşıması mümkündür.
Teşhis
Olası bir kistik fibroz, doğumdan önce bile doğum öncesi teşhis yoluyla tespit edilebilir. Ailenin zaten hasta bir çocuğu varsa genellikle önerilir. İndeks hasta olarak adlandırılan kistik fibroz hastasının kardeşleri ve heterozigot ebeveynlerin kardeşleri için de endike olabilir. Bu, örneğin tüp bebek yoluyla çocuk sahibi olmak isteyen kistik fibroz hastaları için de geçerlidir . Endeks hastasının daha uzak akrabaları için genellikle doğum öncesi tanı için bir neden yoktur. Onlar için kistik fibrozlu bir çocuğa sahip olma riski, genel perinatal mortaliteden daha azdır . Prenatal tanıdan önce, ebeveynleri işlemin tüm riskleri, hastalığı ve kürtaj olasılıkları hakkında bilgilendirmek için ayrıntılı bir klinik-genetik konsültasyon gereklidir . Prenatal tanı öncesinde indeks hasta ve ebeveynlerinin kanından CFTR genotip analizi yapılır. İndeks hastanın mutasyon genotipi biliniyorsa, fetal materyalden DNA kullanılarak prenatal tanı mümkündür. Örnek toplamak için iki yöntem belirlenmiştir: koryon villus örneklemesi ve amniyosentez (amniyotik sıvının incelenmesi). İlki genellikle gebeliğin 10. ila 14. haftasında , ikincisi ise 12. ila 16. haftalarda yapılır .
Ter testi bebeklerde ve çocuklarda şüpheli kistik fibrozis için tercih edilen bir yöntemdir. Tıbbi madde pilokarpin yardımıyla ter atılımı uyarılır. Bunu yapmak için cilde, pilokarpinin cildin ter bezlerine difüzyonuna aracılık eden zayıf bir doğru akım uygulanır . Bu işleme iyontoforez denir. Bir kılcal damar ile uyarılmış alandan bir ter örneği emilir ve numune sodyum veya klorür içeriği için kantitatif olarak analiz edilir. Numunedeki sodyum klorür içeriği 80 mmol / l'nin üzerindeyse , önemli bir kistik fibroz şüphesi vardır. Normal değer 5 mmol / L ila 55 aralığındadır. Ter testi genellikle iki gün boyunca tekrarlanır. Pozitif çıkarsa veya sonuçlar yetersizse genellikle DNA analizi (genetik test) yapılır .
Ter testine daha karmaşık bir alternatif , kan serumunda immünoreaktif tripsin tayinidir . Genellikle yaşamın beşinci gününde gerçekleştirilir. Bu amaçla topuktan tam kan alınır ve radyoimmunoassay ile tripsin belirlenir . Normal değer 80 ng/ml'nin altındadır. Sonuçlar ter testinden daha anlamlıdır.
Kistik fibroz için ilk yenidoğan tarama (NGS) programları 1981'de Yeni Zelanda ve Avustralya'da başladı . İsviçre'de kistik fibroz, 2011'den beri yenidoğan taramasının bir parçası olarak kistik fibroz için rutin olarak kontrol edilmektedir. Şu anda (2013 itibariyle) bu, Amerika Birleşik Devletleri, İngiltere, İrlanda, İskoçya, Fransa, Avusturya, Polonya, Hollanda ve İtalya ve İspanya bölgelerinde de yapılmaktadır.
In Mecklenburg-Vorpommern , kistik fibroz için bir test teklif edildi parçası olarak tüm yenidoğanlarda yenidoğan taraması metabolik hastalıklar için 2012 yılından bu yana . 2013 yılında Almanya'da yeni doğan bebeklerin sadece yaklaşık %15'i kistik fibroz için muayene edildi. Bu nedenle, kistik fibrozlu çocukların sadece yaklaşık %58'ine yaşamın ilk yılında hastalık teşhisi konur. Ortalama tanı yaşı 4.8 yıldır. Hastaların %7,6'sı ilk tanı anında (2012 itibariyle) 18 yaş ve üzerindedir. Erken teşhis, hastanın seyrini ve yaşam kalitesini iyileştirebilecek zamanında tedaviyi mümkün kılar. Klinik tanı ile karşılaştırıldığında, uzun vadeli bir maliyet avantajı vaat ediyor. Yıllardır, özellikle tıp mesleğinde ülke çapında yenidoğan taramasına talep var. Amerika Birleşik Devletleri, Birleşik Krallık, Fransa ve Avustralya'da gen tabanlı bir teknik kullanılmaktadır. Alman Genetik Teşhis Yasası buna yalnızca katı koşullar altında izin verir. Almanya'da tripsin testinin tercih edilmesinin nedenlerinden biri de budur.
Yenidoğan taramasının yararlılığı için temel bir kriter, Dünya Sağlık Örgütü (DSÖ) tarafından belirlenen , “ Etiyolojisi ve patogenezi anlaşılan, latent veya erken semptomatik bir aşamadan sonra ortaya çıkan ciddi bir hastalık olmalıdır ” ilkesidir. başarılı bir tedavi için uygun test ve muayene yöntemlerinin mevcut olduğu tıbbi ve organizasyonel olanaklardır ”.
Öjenik amaçlı genel heterozigot taraması, çoğu genetikçi, çocuk doktoru ve özellikle yetişkin kistik fibroz hastaları tarafından kesinlikle reddedilir. Tripsin testinde özelliklerin heterozigot taşıyıcılarının tespiti de sorunlu olarak görülmektedir. Kistik Fibrozis için Avrupa Topluluğu Uyumlu Eylem önerilen sınırlandırılması için testi CFTR pozitif aile öyküsü olan konulara heterozi-.
2005 yılında, tarama yoluyla 'kistik fibroz'un ilk tanısının sadece %6'sı bulundu. En sık tanı pulmoner (%27.6) ve gastrointestinal semptomlarla birlikte pulmoner semptomlara (%21.6) dayanıyordu. Saf gastrointestinal şikayetler %14,2'de karşılık gelen bulguya ve %11.2'de mekonyum ileusa yol açtı. Vakaların %6.7'sinde kardeşti.
1 Eylül 2016 tarihinden itibaren ülke genelinde genel yenidoğan taraması yapılmaktadır. İmmünoreaktif tripsin, pankreatit ile ilişkili protein ve CFTR genetiğini içerir.
terapi
Sayesinde fizyoterapi , inhalasyon ve ilaç, son yıllarda pazara gelmiş özellikle sürekli geliştirilmiş sindirim enzimleri ve antibiyotikler, hasta insan prognoz son yıllarda önemli ölçüde iyileşmiştir. Bununla birlikte, tedavinin iyileştirici bir etkisi yoktur, sadece semptomatiktir . Kistik fibroz, çeşitli organları etkileyen sistemik bir kusurdur. Nedensel bir tedavi (örn. gen tedavisi yoluyla ) vakaların yaklaşık %97'sinde gerçekçi olarak imkansız olduğundan, bireysel organ sistemlerinin her bir bozukluğu ayrı ayrı tedavi edilmelidir.
semptomatik tedavi
Gelişmesi geciken çocuklarda büyüme hormonu tedavisi endike olabilir . Daha iyi vücut ağırlığı ile daha iyi büyüme aynı zamanda daha az hastaneye yatış, daha az antibiyotik tedavisi ve daha iyi akciğer fonksiyonu sağlar . Takviyesi ile vitamin A , D , E ve K semptomatik tedavinin önemli bir parçasıdır.
Hastanın akciğerleri genellikle akciğer dokusuna kalıcı olarak zarar veren tekrarlayan enfeksiyonlardan etkilenir. Özellikle Pseudomonas aeruginosa , Burkholderia cepacia veya dirençli mikroplar gibi problemli mikroplar ciddi pnömoniye neden olabilir. Bu nedenle bu mikroplarla mücadele büyük önem taşımaktadır. Etkilenen yetişkinlerin çoğunun akciğerleri, Pseudomonas aeruginosa bakterisi ile kronik olarak kolonize olur ve bu da sıklıkla akciğer durumunda bir bozulmaya yol açar. Bahsedilen bakterilerden bazıları, örn. B. Pseudomonas aeruginosa viskoz mukus ile birlikte hastanın akciğerlerinde bir biyofilm oluşturur . Sert mukus, bakterilere, kelimenin tam anlamıyla saklandıkları ve antibiyotikler için erişimlerinin zor olduğu ideal bir üreme alanı sağlar. Burada, yüksek doz antibiyotikler genellikle intravenöz olarak ve 14 günlük bir süre boyunca üç aylık aralıklarla uygulanır.
Kistik fibrozun antimikrobiyal tedavisinde dört terapötik ilke arasında bir ayrım yapılır:
- profilaktik uzun süreli tedavi (patojen tespiti yok, semptom yok)
- Erken tedavi veya eradikasyon tedavisi (patojen tespiti, semptom yok)
- Alevlenme tedavisi (patojen, semptom kanıtı olsun veya olmasın)
- Bastırma tedavisi (kronik patojen tespiti, solunum yollarının hiç olmaması veya kronik semptomları)
Kalın mukusu gevşeten inhalasyon ilaçlarına ek olarak, bronşları genişletmek için inhalasyon ilaçları ve ayrıca inhalasyon yoluyla uygulanan antibiyotikler ve kortikosteroidler de kullanılır. Siprofloksasin - 5 yaşından büyük çocuklar için - ve gentamisin genellikle Pseudomonas aeruginosa'ya karşı uygulanır . Ekspektoranlar inhale edildikten sonra otojen drenaj veya modifiye otojen drenaj kullanılır. Her ikisi de hastanın derin solunum yolundan viskoz salgıyı dışarıdan yardım almadan pompalamasını ve ardından öksürmesini sağlayan özel olarak geliştirilmiş nefes alma teknikleridir.
Artan akciğer yetmezliği ile soluduğumuz havaya kalıcı olarak oksijen eklenir ( uzun süreli oksijen tedavisi ). Pulmozyme markası altında , rekombinant insan DNase (rhDNAse, Dornase alpha), mukusta bulunan DNA filamentlerini çözmek için inhale ilaç olarak kullanılır. Bu DNA filamentleri, nötrofillerin kalıntılarıdır . Nötrofil granülositler, oraya yerleşmiş bakterilere saldırmak için akciğerlere göç eden bağışıklık sisteminin hücreleridir. Nötrofiller daha sonra bağışıklık sisteminin diğer hücreleri tarafından atılır, söz konusu nötrofillerin DNA filamentleri kalır. Bu DNA filamentleri ayrıca akciğerlerdeki zaten sert olan mukusun dayanıklılığına da katkıda bulunur. Dornase alfa uygulaması, mukusun dönebilirliğini azaltır ve mukosiliyer klirensi iyileştirir.
Diabetes mellitus veya safra asitlerinin üretiminin bozulması gibi özel problemlerde bu hastalıkların da ilaçla tedavi edilmesi gerekir. Mekonyum ileus eşdeğeri olarak adlandırılan bir bağırsak tıkanıklığı meydana gelirse, derhal tıbbi yardım alınmalıdır.
Kistik fibrozda osteoporoz tedavisi için henüz bir kılavuz yoktur. Kalsiyum ve D vitamini ikamesi içeren sağlıklı bir diyet ve fiziksel aktivite de dahil olmak üzere önleyici tedbirlere odaklanılmalıdır. Prensipte, mevcut osteoporoz bifosfonatlar , hormon replasman tedavisi veya kalsitonin ile tedavi edilebilir . Kistik fibrozlu hastalarda bifosfonat tedavisi ile ilgili mevcut birkaç çalışma, kemik yoğunluğunda bir artış göstermektedir, ancak kemik kırıklarının sayısı önemli ölçüde azalmamıştır. Kistik fibrozlu hastalarda raloksifen , stronsiyum ranelat ve teriparatid ile osteoporoz tedavisine ilişkin henüz hiçbir çalışma sonucu mevcut değildir. Büyüme hormonlarının uygulanması genellikle çocuklarda ve ergenlerde kemik yoğunluğunun artmasına neden olur.
Hastanedeki özel bir poliklinikte, bir üniversite kliniğinde veya asistan bir uzmanla yapılan düzenli kontroller, tedavinin önemli bir parçasıdır.
2008 baharında , Essen Clinic'teki amitriptilin endikasyonu kistik fibrozu da içerecek şekilde genişletildi. Amitriptilin, dolaylı olarak asit sfingomiyelinazını inhibe eder ve böylece FIASMA (asit sfingomiyelinazın fonksiyonel inhibitörü) olarak işlev görür .
destekleyici önlemler
Neden olduğu kilo kaybı ile pankreas yetersizliği olan karşı etkide uygulanmasıyla yüksek enerji, yüksek yağlı yiyecek ve sindirim enzimleri (uygulanmasından pancreatins , fungal enzimler ). Kistik fibroz hastalarının vücut ağırlığı büyük önem taşımaktadır. Normal veya ideal kilo ne kadar uzun süre korunabilir ve düşük kilo önlenebilirse, akciğer fonksiyonu üzerinde o kadar faydalı olacaktır. Ciddi derecede düşük kilolu hastalar, kontroller sırasında normal vücut ağırlığına sahip olan veya sadece minimum kilolu olan hastalara göre genellikle daha kötü akciğer fonksiyon değerleri gösterir. Bu kuralın elbette istisnaları vardır. Zor nefes almanın (örneğin akciğerlerin tıkanması nedeniyle ) tekrar enerji harcamasını arttırdığına dikkat edilmelidir . Bu gerçek genellikle gıda enerjisi alımını artırarak dikkate alınır .
Destekleyici terapi, koşma, koşma, bisiklete binme, dans etme vb. gibi düzenli spor aktivitelerini içerir. Birey için en uygun spor, ilgili sağlık durumuna uyarlanır ve ilgili doktor tarafından önerilir.
Akciğer nakli
Özellikle akciğer, karaciğer ve pankreas olmak üzere organ nakilleri artık nakil merkezlerinde düzenli olarak yapılmaktadır ve birçok insan için kistik fibroz tedavisinde bir alternatif oluşturmaktadır.Ancak bu endikasyon için akciğer naklinin yararı tartışmalıdır.
Eğer bir saniyelik kapasitesi FEV 1 akciğer normal aralığın% 30 değerinin altına düştüğünde ve kan (tükürme hemoptiziye ) daha sık meydana gelir, iki yıllık sağkalım oranı sadece yaklaşık% 50'dir. Bu gibi durumlarda akciğer nakli uygun olabilir. Bununla birlikte, bir organ bağışı için bekleme süresi bir ila üç yıldır ve sadece her üç ila altı hastadan biri bir bağış organı alabilir. Bu nedenle, organ bağışçılarının olmaması nedeniyle, organ bağışı için başvuranların çoğu ölmektedir. Genellikle çift akciğer nakli yapılır. Bu gereklidir, çünkü donör organın reddedilmesini önlemek için kullanılan immünosupresyon , kalan akciğerlerin enfeksiyonlarını zorlayacaktır. Ek olarak, verici organ enfekte olur. Akciğer nakli sonrası üç yıllık sağkalım oranı %60 civarındadır.
Hastalığın birincil nedeninin ilaç tedavisi
Hastalığın birincil nedeninin tıbbi tedavisi, yani CFTR proteininin kusuru veya ciddi şekilde kısıtlanmış işlevi, altı mutasyon sınıfına dayanmaktadır. Mutasyon sınıfları I ve II için sözde düzelticiler ve sınıf III mutasyonlar için güçlendiriciler geliştirilmektedir . Düzelticiler, kusurlu CFTR'yi düzeltmek için tasarlanmıştır ve güçlendiriciler, işlevselliği veya klorür kanallarının sayısını artırmak için tasarlanmıştır. Araştırmanın amacı, CFTR fonksiyonunu normalin en az %5'ine çıkarmaktır. Bu seviyenin üzerinde semptomların ciddiyetinin önemli ölçüde azaldığına veya hastalığın ana belirtilerinin ortadan kaldırılabileceğine inanılmaktadır.
Onaylanmış ilaçlar
İle ivacaftor ( Kalydeco ait) Vertex İlaç 2012 yılında ilk ilaç oldu onaylı kistik fibrozis birincil nedeni karşı yönlendirildiği,. Bu noktaya kadar, kistik fibroz sadece semptomatik olarak tedavi edilebiliyordu. Ivacaftor, Ocak 2012'de Gıda ve İlaç Dairesi (FDA) ve o yılın Temmuz ayında Avrupa İlaç Ajansı (EMA) tarafından G551D mutasyonuna sahip altı yaş üstü hastaların tedavisi için onaylandı. Tüm kistik fibroz hastalarının yaklaşık %4 ila 5'i bu mutasyona sahiptir. Bu, dünya çapında yaklaşık 3000 hastaya karşılık gelmektedir. Avrupa'da yaklaşık 1500 kistik fibroz hastası G551D mutasyonuna sahiptir. Almanya'da kistik fibroz hastalarının sadece yaklaşık %2'si ivacaftor tedavisi için gerekli endikasyona sahiptir. Kistik fibroz için kişiselleştirilmiş tıp dönemi, ivacaftor'un onaylanmasıyla başladı . Amerika Birleşik Devletleri'ndeki tedavi maliyetleri, hasta başına yılda yaklaşık 300.000 ABD dolarıdır. Ivacaftor, ABD hasta kuruluşu Cystic Fibrosis Foundation'ın mali desteğiyle geliştirildi . Vertex Pharmaceuticals toplam 75 milyon dolar aldı. Bunun karşılığında Vakıf, Vertex Pharmaceuticals'tan elde edilen kârın bir kısmını alır. Almanya'da hasta ve yıl başına 330.000 €'yu aşan tedavi masrafları tamamen yasal sağlık sigortaları tarafından karşılanmaktadır. Karşılaştırıldığında, standart tedavinin ilaç maliyetleri hasta ve yıl başına yaklaşık 21.000 €'dur. Bir akciğer naklinin yaklaşık 150.000 € olduğu tahmin edilmektedir. G551D mutasyonu, CFTR kanalında bir sınıf III kusura neden olur. Ivacaftor, CFTR güçlendiriciler grubuna aittir. Arızalı CFTR kanalını açan, böylece CFTR'nin azalmış aktivitesini artıran bir CFTR kanal açıcıdır. İlk klinik sonuçlar umut vericidir. Hastalar hızla kilo alırlar ve akciğer fonksiyonu birkaç hafta içinde önemli ölçüde düzelir.
Şubat 2014'te, ivacaftor, sekiz mutasyona sahip kistik fibroz hastalarının tedavisi için FDA tarafından onaylandı. Bunlar G178R, S549N, S549R, G551S, G1244E, S1251N, S1255P ve G1349D mutasyonlarıdır.
Şimdi ivacaftor ve tezacaftor kombinasyonu da onaylandı .
Deneysel ajanlar ve tedavi kavramları
1989'da CFTR geninin keşfi , kistik fibroz tedavisinde tamamen yeni yollar açtı. Başlangıçta gen tedavisine büyük umutlar bağlandı . İlk gen tedavisi 1993 yılında bir kistik fibroz hastasında gerçekleştirilmiştir. Bunu 20'den fazla başka klinik çalışma izledi. mRNA'nın taşınması için çeşitli viral vektörler kullanıldı. Şimdiye kadar, tüm klinik çalışmalar umut verici preklinik verilere rağmen başarısız olmuştur . Başarısızlığın nedenleri çeşitliydi ve “ transfeksiyonun yetersiz etkinliği ” ile “çok kısa etki süresi” ve “hedef dokuda önemli inflamatuar yan etkiler” arasında değişiyordu .
Sınıf I mutasyonundaki düzeltmenler grubu deneysel ilaç ataluren'i duydum . Ataluren, yanlış ayarlanmış bir durdurma kodonunun ötesinde CFTR geninin doğru okunmasını sağlamayı amaçlamaktadır . Ataluren'in özellikle stop kodonu UGA ile etkili olduğu söyleniyor. Ataluren oral olarak mevcuttur ve ilk klinik çalışmalar umut verici sonuçlar göstermiştir . Ataluren şu anda (Mart 2015 itibariyle) klinik faz III'tedir. Çalışmanın Kasım 2016'da sona ermesi bekleniyor.
Lumacaftor (kod adı VX-809), mutasyon sınıfı II'deki CFTR kusurlarını ortadan kaldırmayı amaçlayan deneysel bir ajandır. ΔF508 mutasyonlu hastaların tedavisi için ivacaftor ile kombinasyon halinde klinik olarak test edilmektedir. Bir düzelticiyi bir güçlendirici madde ile birleştirmenin ardındaki mantık, düzelticinin mutasyona uğramış CFTR proteininin hücre zarına taşınmasını sağlaması ve güçlendirici maddenin oradaki klorür kanalının işlevini aktive etmesi gerektiğidir. Lumacaftor + ivacaftor kombinasyon tedavisi şu anda (Mart 2015 itibariyle) klinik faz III'tedir.
Düzelticiler grubu ayrıca kimyasal refakatçileri de içerir . Bu potansiyel aktif bileşenler, protein katlama sürecini desteklemeli veya CFTR'nin doğru protein katlanmasını sağlamalıdır. Bu nedenle, sınıf II genetik kusurları telafi etmeleri amaçlanmıştır. Kimyasal şaperonlar, tüm hücresel protein katlama süreçleri üzerinde spesifik olmayan bir etkiye sahiptir. Bu şaperonlardan biri sodyum fenilbutirattır . Geçmişte bu aktif bileşenle çeşitli klinik çalışmalar yapılmıştır. Umut verici sonuçlar elde edilmesine rağmen, bunun için gereken dozlar günde 20 gram civarında son derece yüksektir ve önemli ölçüde daha düşük dozlarda bile yan etkiler dikkate değerdir. Bu terapötik yaklaşım bu nedenle daha fazla takip edilmeyecektir. Son klinik çalışma 2011'de iptal edildi. Sodyum fenilbutirat, hiperamonyemili hastaların tedavisi için onaylanmıştır. Kistik fibroz tedavisi için onay yoktur. Bir fenilbutirat trigliseriti olan potansiyel aktif bileşen gliserol tri-(4-fenilbutirat), şu anda kistik fibroz tedavisi için klinik faz II'dedir. Bu bileşik, önemli ölçüde daha fazla lipofiliktir ve muhtemelen daha iyi tolere edilir. Dozlar da günde 30 gram aralığında çok yüksektir.
Haziran 2013'te EMA , furocoumarin 4,6,4'-trimethylangelicin'e (TMA) yetim ilaç statüsü verdi . TMA'nın iki işlevli bir etki mekanizmasına sahip olacağı umulmaktadır. Bir yandan bileşik, mutasyona uğramış CFTR'nin işlevini geri kazanmalı veya aktivitesini arttırmalı ve diğer yandan interlökin-8 ekspresyonunu aşağı doğru düzenleyerek bir anti-inflamatuar etkiye sahip olmalıdır . TMA'nın ΔF508 mutasyonu olan hastalarda klinik çalışmalarda test edilmesi planlanmaktadır.
Model organizmalar
Araştırma için insan kistik fibrozuna mümkün olduğunca yakın olan uygun hayvan modelleri gereklidir. Bu, hastalığın patolojik tablosuna yol açan fizyolojik süreçlerin daha iyi anlaşılmasını sağlar ve hepsinden önemlisi, tedavi için yeni aktif bileşenler geliştirilebilir ve insanlarda kullanılmadan önce klinik öncesi test edilebilir. İdeal hayvan modeli, hava yollarındaki enflamatuar süreçler, bakteriyel enfeksiyonların kendiliğinden gelişimi ve kronik bir enfeksiyona ilerleme gibi temel özellikleri yansıtmalıdır. CFTR eksikliği olan fare, CFTR geninin keşfinden üç yıl sonra, 1992 gibi erken bir tarihte geliştirildi. Bu model organizmaya büyük umutlar bağlandı, ancak bunlar yerine getirilemedi. Örneğin "kistik fibroz faresi" ( Cftr - nakavt ), akciğerlerde herhangi bir spontan enfeksiyon geliştirmez. Büyük miktarlarda kistik fibroz tipik akciğer patojenlerinin aşılanması bile, farelerin bağışıklık sistemi tarafından hızla ortadan kaldırılır. Bu nedenle, Cftr nakavt fare, yeni antibakteriyel veya anti-inflamatuar tedavi konseptleri geliştirmek için pek uygun değildir.
Yerli domuzlar daha uygundur . 2008'den beri Cftr eksikliği olan domuzlar ve 2011'den beri de homozigot ΔF508 domuzları olarak var olmuşlardır . Bu hayvanlar, enfeksiyonlar, iltihaplar, ağır mukus ve hava yolu tıkanıklığı ile karakterize edilen tipik kistik fibroz akciğer hastalıklarını kendiliğinden geliştirir. İnsanlarda ve domuzlarda Airway Surface Liquid'in yapısı da benzerdir. 2010 yılından beri piyasada bulunan kistik fibroz gelinciği de erken gençlik döneminde spontan akciğer enfeksiyonları geliştirir ve kistik fibroz araştırmalarında model organizma olarak kullanılır. Her iki hayvan modeli üzerinde yapılan araştırmalar, CFTR proteininin, Hava Yolu Yüzey Sıvısını nemlendirme rolünün çok ötesine geçen mukozal bağışıklıkta doğrudan bir rol oynadığı hipotezini desteklemektedir .
tahmin
Yirmi yıl önce kistik fibrozlu birçok hasta ergenlik döneminde ölürken , sürekli gelişen tedavi seçenekleri sayesinde artık 40 yaşına ulaşma şansı oldukça yüksektir. Günümüz yeni doğanları için 45 ile 50 yaş arası bir değer verilmektedir. Dünya çapında, kistik fibroz hastalarının %50'den fazlası artık 18 yaşın üzerindedir.
Mutasyon sınıfları içinde, sayı arttıkça prognoz genellikle daha elverişli hale gelir. I'den III'e kadar olan sınıflar 'yüksek risk grubu' ve IV ila VI arasındaki sınıflar 'düşük risk grubu' oluşturur. 2006 yılında yayınlanan bir çalışmada, 1672 kistik fibroz hastası ölümü bu iki risk grubuna atanmıştır. Düşük risk grubundaki hastaların ortalama yaşı 37.6 ( IQR 28.8-47.9) ve yüksek risk grubundakilerin yaşı 24.2 (IQR 18.4-32.0) idi. Minimal derecede hasta insanlar normal bir yaşam beklentisine sahiptir ve baba veya çocuk sahibi olabilirler.
Önemli ölçüde iyileşen prognoz nedeniyle, klinik tablo da biraz değişti. Osteoporoz ve diabetes mellitus gibi geç komplikasyonlar artık çok daha yaygın. Kistik fibroz eskiden çocuk doktorları için bir hastalık iken, şimdi dahiliyeciler ve göğüs hastalıkları uzmanları için giderek daha önemli hale geliyor . Ayrıca erişkin kistik fibroz hastalarında yaygın olarak görülen depresyon ve anksiyete gibi psikolojik yan etkiler de vardır.
Heterozigot özellik taşıyıcıları
Heterozigot CFTR mutasyon taşıyıcıları, kistik fibroz geliştiremez, ancak CFTR proteininin önemli ölçüde daha düşük ekspresyonuna sahiptir. Bir dizi çalışma, bunun başka sağlık etkileri olup olmadığına baktı - hem olumsuz hem de olumlu.
Genel hastalık riskleri
Heterozigot CFTR mutasyon taşıyıcılarının pankreatite (pankreas iltihabı) daha duyarlı olduğu kesindir . İdiyopatik kronik pankreatit geliştirme riski, kusurlu bir CFTR geni olmayan insanlara göre iki ila on bir kat daha fazladır . Bunun kesin nedenleri hala bilinmiyor.
1976 gibi erken bir tarihte, bir çalışma heterozigot CFTR mutasyon taşıyıcılarının da alerjilere daha duyarlı olduğunu buldu. Heterozigot CFTR mutasyon taşıyıcılarında artan astım riski arasındaki bağlantıya ilişkin çalışma sonuçları şimdiye kadar çelişkili olmuştur. Artmış bir riskten hafif bir koruyucu işleve kadar uzanırlar.
Bir bütün olarak popülasyona bakıldığında, kadın ve erkek özelliklerin taşıyıcılarının üreme kapasitesi, popülasyonun geri kalanınınkine tekabül ediyor gibi görünüyor. KFTR mutasyonlarının artması da kronik bronşit , kronik obstrüktif akciğer hastalığı (KOAH) geliştiği anlamına gelmez .
Kistik fibroz hastaları gibi, özelliklerin taşıyıcıları da kan basıncını düşürmüştür . Geçmişte bu bulgu artan elektrolit kaybıyla açıklanıyordu. Bununla birlikte, 2013'ten daha yeni çalışmalar, azalmış CFTR ifadesinin kan damarlarında da değişikliklere neden olduğunu göstermektedir. Agonist endüklenmiş salma kalsiyum iyonları ile düz kas hücrelerinden aort azalır. Bu da kan basıncını düşürür. Düşük kan basıncının özelliklerin taşıyıcılarında etkisi özellikle ileri yaşta ve sistolik kan basıncında fark edilir. 1200'den fazla test kişisiyle yapılan bir İngiliz çalışmasında, özelliklere sahip heterozigot kadınların sistolik kan basıncı 7 mmHg ve diyastolik kan basıncı karşılaştırma grubundan 4 mmHg daha düşüktü. Düşük kan basıncı, felç ve koroner arter hastalığına karşı daha fazla koruma sağlar . Çalışmanın yazarları, kan basıncı değerlerinden heterozigot kadınların felç riskinde %30 ve miyokard enfarktüsü riskinde %20 azalma olduğunu hesapladılar .
Çalışmalar, CFTR heterozigot kadınların, mutasyona uğramamış iki CFTR aleli olan kadınlara kıyasla doğurganlığında azalma olmadığını göstermiştir.
Heterozigot genotipin seçim avantajı
Bu kadar ciddi bir hastalığa neden olan bir alelin neden bu kadar yaygın olduğuna ve evrim sürecinde seçilmediğine dair şu anda kesin bir açıklama yok . Küçük, izole popülasyonlarda, kistik fibroz sıklığı, genetik sürüklenme ve kurucu etki ile açıklanabilir. Genel olarak, büyük popülasyonlarda ölümcül bir resesif kalıtsal hastalık, tek başına bu iki etki yoluyla bu kadar yüksek bir sıklığa ulaşamaz. Tüm popülasyon genetik verileri , en önemli CFTR mutasyonlarının yüksek sıklığının ana nedeni olarak heterozigot bir avantaj olduğunu göstermektedir . Bu , fonksiyonel klorür kanallarının sayısında bir azalmaya yol açan iki CFTR alelinin sadece birinde fonksiyon kaybının bir seçim avantajı ile sonuçlandığı anlamına gelir. Heterozigot avantajın en iyi bilinen örneği, orak hücreli anemideki özelliklerin heterozigot taşıyıcılarıdır.Büyük ölçüde semptomsuzdurlar, ancak sıtmaya yakalanma olasılıkları önemli ölçüde daha düşüktür. Kistik fibroz durumunda, özelliğin heterozigot taşıyıcılarının hangi hastalıklara karşı artan bir direnç gösterdiğine dair bir takım hipotezler yapılmıştır. Bu direnç, gen kusurunun son derece sık yayılmasına yol açan seçim avantajını sunar. Kistik fibrozu en yaygın kalıtsal hastalıklardan biri haline getiren bu seçim avantajı bugüne kadar kesin olarak belirlenememiştir.
Diğer şeylerin yanı sıra, belirli patojenlere karşı daha yüksek direnç olduğundan şüphelenilmektedir . Kolera toksininin bağırsak epitelinde artan CFTR ekspresyonuna yol açtığının ve bunun kolerada büyük su kaybına yol açtığının keşfedilmesiyle , bunun heterozigot özellik taşıyıcıları için seçim avantajı olduğu hipotezi ortaya atıldı. Bakteri Salmonella Typhimurium CFTR yoluyla epitele ulaşır, bu nedenle heterozigot taşıyıcılarda azalmış CFTR ekspresyonunun tifo geliştirme olasılığını azalttığı varsayılır . Bu patojen ayrıca CFTR'nin ekspresyonunu da destekler. Tifo ateşinin endemik olduğu bölgelerde , hastalık olasılığı ile CFTR genotipi arasındaki korelasyon doğrulandı. Bununla birlikte, incelenen alanlarda kistik fibroz son derece nadirdir ve 775 test deneğinin hiçbirinde ΔF508 mutasyonu bulunmamıştır. Kolera ve tifo yayılım alanları, bu alanlardaki CFTR mutasyonunun sıklığı ile korele değildir , bu da bu iki hipoteze karşı bir göstergedir. Tarihsel demografik ve epidemiyolojik verilere dayanan matematiksel modeller ayrıca ne kolera ne de tifüsün yüksek kistik fibroz insidansını açıklamak için yeterli seçim baskısına sahip olamayacağını göstermektedir.
Buna karşılık, bu modeller, klinik ve moleküler biyolojik verilerle birlikte , geçmişte tüberkülozdaki seçim baskısının yeterince yüksek olduğunu göstermektedir. 16. yüzyılın başından 20. yüzyılın başına kadar, tüberküloz Avrupa'da salgındı (“beyaz veba”) ve ölümlerin %20'sinden fazlasından sorumluydu. Tüberküloz bu nedenle son derece yüksek bir seçim baskısına sahiptir. Tüberküloz hipotezi, kistik fibroz hastalarının nadiren tüberküloz geliştirdiğine dair klinik gözlem temelinde 1967 gibi erken bir tarihte kurulmuştur. Daha sonra, heterozigot CFTR taşıyıcılarında tüberkülozdan daha düşük bir ölüm oranı bulundu. Kistik fibroz hastalarının tüberküloza karşı artan direncinin nedeni muhtemelen arilsülfataz B enziminin azalmış aktivitesidir . Hastalığa neden olan mikobakteriler , arilsülfataz B yerine arilsülfotransferaz enzimine sahiptir , bu nedenle hücre duvarlarını oluşturmak için konakçılarının sülfat kaynaklarına bağımlıdırlar . Bu kaynakların yokluğunda mikobakteriler yeterince çoğalamaz. Tüberküloz hipotezi, seçim faktörleri için üç kriteri karşılar: moleküler-biyolojik, klinik ve tarihsel-coğrafi kriter. Kistik fibrozun kökenine tekabül eden Mycobacterium tuberculosis'in yaklaşık 35.000 yıl önce ilk ortaya çıkışı, tüberküloz hipotezi lehinde konuşuyor . Bu tüberküloz hipotezinin doğru olduğunu varsayarsak, gelişmiş ülkelerde doğurganlık çağındaki kişilerin tüberküloz mortalitesinin önemli ölçüde daha düşük olmasıyla birlikte, kistik fibroz insidansının önümüzdeki 100 yıl içinde her yıl %0,1 oranında azalması gerekir. İnsidansı yarıya indirmek için bu ülkelerde yaklaşık 20 nesil gerekir.
Başka bir hipotez, genel yetişkin laktoz toleransı ile belirli kolonilerdeki hastalık insidansı arasındaki bir korelasyona dayanmaktadır . Oran, her biri yüksek laktoz toleransına sahip Avrupa kökenli Avrupa ve Kuzey Amerika popülasyonlarında en yüksek iken, Asya'da yaygın laktoz intoleransı için en düşük orandır. Bundan, gen kusurunun yok olmasına henüz izin vermemiş olan özelliklerin heterozigot taşıyıcıları için bir bağlantı ve ayrıca bir seçim avantajı elde edilebilir.
Bir seçim avantajı olarak heterozigot özellik taşıyıcılarının doğurganlığının artmasıyla ilgili hipotezler epidemiyolojik olarak doğrulanamadı.
Tıbbi geçmiş
Gönderen mutasyon sıklığı biz kistik fibroz çok eski bir gen mutasyonu olduğunu biliyoruz analiz eder. ΔF508 gibi CFTR genindeki en yaygın mutasyon türleri, yaklaşık 51.000 yıl önce Arap-Orta Doğu bölgesinde ortaya çıkmıştır. Beluç'un etnik grubu muhtemelen orijinal nüfustu. O zamanlar İran Platosu'nda çapraz göç yolu üzerinde merkezi bir konumda yaşıyorlardı . Bu sayede kistik fibroz avcılar tarafından hızla Avrupa'ya yayılmayı başardı. MÖ 30.000 ila 40.000 civarında , son Buz Devri'nden önce orada ortaya çıktı . İlk kez Üst Paleolitik'in başında .
Geriye dönüp bakıldığında, kistik fibrozun klinik tablosu, tıp literatüründe 17. yüzyılın ortalarından itibaren bir dizi vaka çalışmasında bulunabilir. Bununla birlikte, bunun bağımsız bir çoklu sistem hastalığı olduğu kabul edilmedi. Bir belirtilerinin ilk ayrıntılı açıklaması şişmiş, sertleşmiş, beyazımsı parıldayan pankreas bir gelir tarafından otopsi raporuna Leiden anatomist Peter Pauw Pauw bir iddiaya cesedine incelenen yılı 1595. itibaren büyülenmiş 11 yaşındaki bir kız.
Yüzyıllar önce, bebeklerin tuzlu tadı, çocuk sağlığının uğursuz bir işareti ve azalan yaşam beklentisi olarak kabul edildi. Ernst Ludwig Rochholz , 1857'de İsviçre'den Alemannic çocuk şarkısı ve çocuk oyunları adlı kitabında bu konuda şunları yazdı :
"Öpüldüğünde alnına tuzlu gelen çocuk yakında tekrar ölecek."
Literatürde, İsviçre Almancası sözlüğünün versiyonu sıklıkla alıntılanır:
"Alnından öptüğünüzde tuzlu tadı olan çocuğa yazıklar olsun, büyülenir ve yakında ölür."
1936'da İsviçreli çocuk doktoru Guido Fanconi , kistik fibrozun klinik tablosunu ilk olarak "Konjenital kistik pankreas fibromatozunda Çölyak sendromu" olarak tanımladı . Yayında, Fanconi ve iki ortak yazarı, küçük çocuklarda görülen ölümcül iki hastalık vakasını anlatıyor. O zaman, bunun çok nadir bir sendrom olduğunu varsaydılar.
Ancak kan gruplarını keşfeden Avusturyalı Karl Landsteiner , 1905 yılında hastalığın semptomlarını zaten tanımlamıştı. İçinde Landsteiner, hayatının beşinci gününde "mide şişkinliği" ile ölen bir kızın vakasını anlatıyor. Otopsi sırasında mekonyumun gri-sarı olduğunu ve "kalınlaştırılmış cam macunu" gibi son derece sert bir kıvamda olduğunu buldu. Bu durumda bağırsak kuvvetleri tarafından hareket ettirilemez. Landsteiner şunları söyledi:
"Bu nedenle, kalınlaşma uzun süredir var olduğundan (yani zaten rahimde. FK) mekonyumun anormal doğasının bağırsak tıkanıklığının nihai nedeni olduğu görülebilir."
Kızın pankreasında bağ dokusunda (fibrozis) "çok önemli bir artış" buldu.
"Kistik Fibrozis" (İng. Kistik fibroz ) terimi , 1938'de Amerikalı çocuk doktoru ve patolog Dorothy Hansine Andersen'i şekillendirdi . Etkilenen organların mukus bezleri ile doku değişikliklerine yöneldiler. Ayrıca klinik tabloyu tanımlayan ilk kişiydi. Amerikalı patolog Sidney Farber , 1944'te kalın mukus üretimi nedeniyle hastalığa "kistik fibroz" adını verdi. Bu atama özellikle Almanca konuşulan ülkelerde kendini kanıtlamıştır.
Penisilin (1944'ten), klortetrasiklin (1948'den), oksitetrasiklin (1950'den), kloramfenikol ve eritromisin (her ikisi de 1951'den) antibiyotiklerin bulunmasıyla, kistik fibroz için palyatif tedavinin temeli oluşturuldu.
1949'da Charles Upton Lowe (1921–2012), kistik fibrozun kalıtsal bir hastalık olduğunu kabul etti. Ayrıca otozomal çekinik kalıtımı belirledi ve hastalığın tek bir gendeki bir kusurdan kaynaklandığını öne sürdü. Kistik fibroz hastalarının terindeki artan elektrolit içeriği ile ilgili ilk yayın 1953 yılında Paul di Sant'Agnese (1914-2005) ve meslektaşları tarafından yapılmıştır. Kistik fibrozlu dokuz çocukta terdeki klorür iyonu konsantrasyonunun üç kat arttığını buldular. Bu bilgi bugün hala ter testinde tanı koymak için kullanılmaktadır. Ayrıca kistik fibrozlu çocuklarda terin tuzlu ve acı tadı hakkında Orta Çağ'dan gelen bilgilere bilimsel bir temel oluşturulmuştur. Bu bilgi aynı zamanda 1959'da Lewis E. Gibson (1927-2008) ve Robert E. Cooke (1920-2014) tarafından pilokarpin iyontoforez ter testinin geliştirilmesinin temeliydi. Paul M. Quinton artan tuz konsantrasyonunun nedenini buldu. 1983 yılında kistik fibroz hastalarının izole edilmiş ter kanallarını ( duktus sudoriferus ) incelediği ve endotelin anormal derecede düşük klorür iyonu geçirgenliğinin neden olduğu çok düşük bir sodyum klorür geri emilimi bulduğu zaman. İki yıl sonra, kistik fibrozun moleküler genetik temeli bulundu. Robert G. Knowlton liderliğindeki uluslararası bir çalışma grubu, kromozom 7'yi genetik kusurun yeri olarak tanımladı. Bu, kistik fibrozlu çocukları olan ailelerde bağlantı analizleri kullanılarak yapıldı . 1989'da CFTR geni ilk kez klonlandı ve üç baz delesyonu ΔF508, çoğu kistik fibroz vakasından sorumlu mutasyon olarak kabul edildi. CFTR geninin araştırılmasında önemli bir yardımcı, o sırada incelenen kistik fibroz hastalarının yaklaşık %70'inde mevcut olan üç-baz delesyonuydu. Klonlama sırasında, CFTR geninin klorür kanalını mı yoksa bir klorür kanalının düzenleyicisini mi kodladığı henüz bilinmiyordu . Bu nedenle kistik fibroz transmembran iletkenlik düzenleyici adı her iki olasılığı da kapsayacak şekilde seçilmiştir.
Kistik fibrozun patofizyolojisi hakkında artan bilgi birikiminin bir sonucu olarak, takip eden dönemde yeni tedavi konseptleri geliştirilebilir ve etkilenenlerin yaşam beklentisi önemli ölçüde uzatılabilir. Şu an için en yüksek nokta, 2012 yılında verilen ve bazı hastalarda kistik fibroz nedeninin tedavi edilebildiği ilk ilacın onaylanmasıdır.
Ayrıca bakınız
- Lubani-al-Saleh-Teebi sendromu (gastrit ve megaloblastik anemi ile kistik fibroz)
Edebiyat
Referans kitapları
- Dietrich Reinhardt, Manfred Götz, Richard Kraemer, Martin H. Schöni (ed.): Kistik fibroz. Springer-Verlag, 2013, ISBN 978-3-642-56796-4 , 611 s. ( Google kitap aramada sınırlı önizleme ).
- Hermann Lindemann, Burckhardt Tümmler, Gerhard Dockter (ed.): Mukoviszidose - kistik fibroz. 4. baskı, Georg Thieme, 2004, ISBN 3-13-138604-5 , 174 s. ( Google kitap aramada sınırlı önizleme )
- Tom O. Hirche, Thomas OF Wagner: Kistik fibrozu güncelleyin. Georg Thieme Verlag, 2013, ISBN 978-3-13-176981-7 , 136 sayfa ( Google kitap aramada sınırlı önizleme )
- Margaret Hodson, Andrew Bush, Duncan Geddes: Kistik Fibrozis. 3. baskı, CRC Press, 2012, ISBN 978-1-4441-1369-3 , 486 s. ( Google kitap aramada sınırlı önizleme )
- Alman Pediatrik Enfeksiyon Hastalıkları Derneği (DGPI): DGPI kılavuzu. Çocuklarda ve ergenlerde enfeksiyonlar. ZDB Kimliği 1308754-x .
- Roland Busch: Kistik fibroz hakkında tarih. Hannover 1995.
Ticaret dergileri
- Journal of Cystic Fibrosis Avrupa Kistik Fibrozis Derneği'nin (ECFS) resmi hakemli dergisi
Yönergeler
- S1- Kılavuz Kistik Fibrozis: Pediatrik Gastroenteroloji ve Beslenme Derneği'nin (GPGE) Beslenme ve Ekzokrin Pankreas Yetmezliği . İçinde: AWMF çevrimiçi (2011 itibariyle)
- Alman Çocuk ve Ergen Tıbbı Derneği'nin (DGKJ) kistik fibrozun S1 kılavuz teşhisi . İçinde: AWMF çevrimiçi (2013 itibariyle)
İnternet linkleri
- Kistik fibrozis. İçinde: Man'da Çevrimiçi Mendel Kalıtımı . (İngilizce)
- Kistik fibrozis. İçinde: Orphanet (Nadir Hastalık Veritabanı).
- DCFH - Deutsche CF-Hilfe - Kistik fibroz eV'si olan kişiler için destek
- Federal Kistik Fibrozis Derneği (CF) Mukoviszidose e. V.
- Kistik fibroz - Bern Üniversitesi'ndeki tıp öğrencileri için öğrenme programı
- Lungeninformationsdienst.de - kistik fibroz
- Mukoland.de - Akciğer nakli yapılmış bir kistik fibroz hastasının uzun süreli blogu
Bireysel kanıt
- ↑ a b c d Kistik Fibrozis Mutasyon Veritabanı: İstatistikler. İçinde: genet.sickkids.on.ca. Arşivlenmiş orijinal üzerinde 11 Temmuz 2017 ; 27 Haziran 2017'de erişildi .
- ↑ a b M. S. Gelman, RR Kopito: Kistik fibroz: moleküler bir hastalık mekanizması olarak mutant proteinlerin erken bozulması. İçinde: Moleküler biyolojide yöntemler. Cilt 232, 2003, sayfa 27-37, doi: 10.1385 / 1-59259-394-1: 27 , PMID 12840537 (inceleme).
- ^ A. Jaffé, A. Bush: Kistik fibroz: on yılın gözden geçirilmesi. In: Göğüs hastalığı için Monaldi arşivleri. Cilt 56, Sayı 3, Haziran 2001, s. 240-247, PMID 11665504 (inceleme).
- ↑ a b Alexander Knorre: Kistik fibrozda transkripsiyon faktörü NF-κB'nin aracılık ettiği ER aşırı yük yanıtının araştırılması. Tez, Albert-Ludwigs-University Freiburg im Breisgau, 2001, s. 30.
- ^ Bir b c Daniel Merk, Manfred Schubert-Zsilavecz: Kişiselleştirilmiş tıp: Yeni kistik fibrozis yaklaşımlar. İçinde: pharmische-zeitung.de. 2011, 13 Mart 2015'te erişildi .
- ^ SC Bell, K. De Boeck, MD Amaral: Kistik fibroz için yeni farmakolojik yaklaşımlar: vaatler, ilerleme, tuzaklar. İçinde: Farmakoloji ve terapötikler. Cilt 145, Ocak 2015, s. 19-34, doi: 10.1016 / j.pharmthera.2014.06.005 , PMID 24932877 .
- ↑ Bir Federal Hükümetin Cevap küçük Söz : çocukluk Kistik fibroz Mücadele . BT-Dr 9/2188 Kasım 26, 1982 (PDF dosyası)
- ↑ a b c d e f g Sabina Gallati: Plazma zarında bir klorür kanalı olarak CFTR'nin işlevi. İçinde: Dietrich Reinhardt, Manfred Götz, Richard Kraemer, Martin H. Schöni (ed.): Kistik fibroz. Springer-Verlag, 2013, ISBN 978-3-642-56796-4 , s. 1–19 ( Google kitap aramada sınırlı önizleme ).
- ↑ a b M. Hergersberg, J. Balakrishnan ve diğerleri: 3905insT adlı yeni bir mutasyon, İsviçre'deki 1173 CF kromozomunun %4.8'ini oluşturur ve ciddi bir fenotipe neden olur. İçinde: İnsan genetiği. Cilt 100, Sayı 2, Ağustos 1997, sayfa 220-223, PMID 9254853 .
- ↑ [1]
- ^ G. Romeo, M. Devoto, LJ Galietta: Kistik fibroz geni neden bu kadar sık görülüyor ? İçinde: İnsan genetiği. Cilt 84, Sayı 1, Aralık 1989, sayfa 1-5, PMID 2691388 (inceleme).
- ↑ a b G. Lucotte, S. Hazout, M. De Braekeleer: Batı Avrupa'daki kistik fibroz mutasyonu DF508 sıklıklarının tam haritası ve mutasyon sıklıkları ile hastalık insidansı arasındaki korelasyon. İçinde: İnsan biyolojisi. Cilt 67, Sayı 5, Ekim 1995, sayfa 797-803, PMID 8543293 .
- ↑ a b c d J. L. Bobadilla, M. Macek ve diğerleri: Kistik fibroz: dünya çapında bir CFTR mutasyon analizi - insidans verileriyle korelasyon ve taramaya uygulama. İçinde: İnsan mutasyonu. Cilt 19, Sayı 6, Haziran 2002, sayfa 575-606, doi: 10.1002 / humu.10041 , PMID 12007216 (inceleme).
- ↑ Y. Yamashiro, T. Shimizu ve ark.: Japonya'da tahmini kistik fibroz insidansı. İçinde: Pediatrik gastroenteroloji ve beslenme dergisi. Cilt 24, Sayı 5, Mayıs 1997, sayfa 544-547, PMID 9161949 .
- ↑ a b C. Castellani, H. Cuppens ve diğerleri: Klinik pratikte kistik fibroz mutasyon analizinin kullanımı ve yorumlanması konusunda fikir birliği. İçinde: Kistik fibroz dergisi. Cilt 7, sayı 3, Mayıs 2008, s. 179-196, doi: 10.1016 / j.jcf.2008.03.009 , PMID 18456578 , PMC 2810954 (serbest tam metin) (inceleme).
- ↑ a b N. Morral, J. Bertranpetit ve diğerleri: Avrupa popülasyonlarında majör kistik fibroz mutasyonunun (delta F508) kökeni. İçinde: Doğa genetiği. Cilt 7, Sayı 2, Haziran 1994, sayfa 169-175 , doi: 10.1038/ng0694-169 , PMID 7920636 .
- ↑ X. Estivill, C. Bancells, C. Ramos: Avrupa popülasyonlarında 272 kistik fibroz mutasyonunun coğrafi dağılımı ve bölgesel kökeni. Biomed CF Mutasyon Analizi Konsorsiyumu. İçinde: İnsan mutasyonu. Cilt 10, Sayı 2, 1997, sayfa 135-154, doi : 10.1002 / (SICI) 1098-1004 (1997) 10: 2 <135 :: AID-HUMU6> 3.0.CO; 2-J , PMID 9259197 .
- ↑ O. Lao, AM Andrés ve diğerleri: Avrupa popülasyonlarında kistik fibroz mutasyon spektrumlarının mekansal modelleri. İçinde: Avrupa insan genetiği dergisi. Cilt 11, Sayı 5, Mayıs 2003, s. 385-394, doi: 10.1038 / sj.ejhg.5200970 , PMID 12734544 .
- ↑ E. Mateu, F. Calafell ve ark.: Ana kistik fibroz mutasyonlarının menşe yeri tanımlanabilir mi? İçinde: Amerikan İnsan Genetiği Dergisi . Cilt 70, sayı 1, Ocak 2002, sayfa 257-264 , doi: 10.1086 / 338243 , PMID 11713719 , PMC 384895 (serbest tam metin).
- ↑ a b J. Sanz, T. von Känel ve diğerleri: CFTR çerçeve kayması mutasyonu 3905 insT ve transkript ve protein seviyesindeki etkisi. İçinde: Avrupa insan genetiği dergisi. Cilt 18, sayı 2, Şubat 2010, s. 212-217, doi: 10.1038 / ejhg.2009.140 , PMID 19724303 , PMC 2987192 (serbest tam metin).
- ↑ a b Sabina Gallati, Dominik Hartl ve diğerleri: Kistik fibroz. İçinde: Erika von Mutius, Monika Gappa ve diğerleri: Pediatrik Pnömoloji. Springer-Verlag, 2013, ISBN 3-642-34827-0 , s. 587-632 ( Google kitap aramada sınırlı önizleme )
- ↑ a b c d e Thilo Dörk, Manfred Stuhrmann: Mukoviszidose (kistik fibroz, CF). İçinde: Detlev Ganten , Klaus Ruckpaul : Monojenik Kalıtsal Hastalıklar Cilt 6, Springer-Verlag, 2013, ISBN 3-642-57043-7 , s. 173-194, Google kitap aramasında sınırlı önizleme
- ^ CFTR mutasyonları veritabanı: CFTR geni. İçinde: Evrensel Mutasyon Veritabanı . 2 Mart 2015'te erişildi .
- ↑ R. Sebro, H. Levy u a. .: p.F508del bileşik heterozigozu için kistik fibroz mutasyonları, ter klorür seviyelerini ve pankreas yeterliliğini tahmin eder. İçinde: Klinik genetik. Cilt 82, sayı 6, Aralık 2012, sayfa 546-551, doi: 10.1111 / j.1399-0004.2011.01804.x , PMID 22035343 , PMC 4279028 (serbest tam metin).
- ↑ a b A. Ahmed, A. Ahmed, P. Patrizio: Kistik fibroz ve doğurganlık. İçinde: Doğum ve jinekolojide güncel görüş. Cilt 25, Sayı 3, Haziran 2013, s. 167-172, doi: 10.1097 / GCO.0b013e32835f1745 , PMID 23429570 (inceleme).
- ^ MP Rogan, DA Stoltz, DB Hornick: Kistik fibroz transmembran iletkenlik düzenleyici hücre içi işleme, kaçakçılık ve mutasyona özgü tedavi için fırsatlar. İçinde: Göğüs. Cilt 139, Sayı 6, Haziran 2011, sayfa 1480-1490, doi: 10.1378 / sandık.10-2077 , PMID 21652558 (inceleme).
- ^ A b C.L. Ward, RR Kopito: Kistik fibroz transmembran iletkenlik düzenleyicisinin hücre içi cirosu. Yabani tip ve mutant proteinlerin verimsiz işlenmesi ve hızlı bozulması. İçinde: Biyolojik Kimya Dergisi. Cilt 269, Sayı 41, Ekim 1994, sayfa 25710-25718, PMID 7523390 .
- ^ MD Amaral: CFTR ve şaperonlar: işleme ve bozulma. İçinde: Moleküler sinirbilim dergisi. Cilt 23, sayı 1-2, 2004, sayfa 41-48, doi: 10.1385 / JMN: 23: 1-2: 041 , PMID 15126691 (inceleme).
- ^ A b S. J. Kim, WR Skach: Endoplazmik Retikulumda CFTR Katlama Mekanizmaları. İçinde: Farmakolojide Sınırlar. Cilt 3, 2012, sayfa 201, doi: 10.3389 / fphar.2012.00201 , PMID 23248597 , PMC 3521238 (serbest tam metin).
- ^ DN Hebert, M. Molinari: Acil servisin içinde ve dışında: protein katlanması, kalite kontrol, bozulma ve ilgili insan hastalıkları. İçinde: Fizyolojik incelemeler. Cilt 87, Sayı 4, Ekim 2007, sayfa 1377-1408, doi: 10.1152 / physrev.00050.2006 , PMID 17928587 (inceleme).
- ↑ CL Ward, S. Omura, RR Kopito: Ubiquitin-proteasome yolu ile CFTR'nin bozulması. İçinde: Hücre. Cilt 83, Sayı 1, Ekim 1995, sayfa 121-127, PMID 7553863 .
- ↑ a b J. R. Riordan, JM Rommens ve diğerleri: Kistik fibroz geninin tanımlanması: tamamlayıcı DNA'nın klonlanması ve karakterizasyonu. İçinde: Bilim. Cilt 245, Sayı 4922, Eylül 1989, sayfa 1066-1073, PMID 2475911 .
- ^ DN Sheppard, MJ Welsh: CFTR klorür kanalının yapısı ve işlevi. İçinde: Fizyolojik incelemeler. Cilt 79, Sayı 1 Ek, Ocak 1999, s. S23-S45, PMID 9922375 (inceleme).
- ↑ a b V. Im Hof, P. Gehr: Mukosiliyer temizleme. İçinde: Christian Rieger, Horst von der Hardt ve diğerleri. (Ed.): Pediatrik Pnömoloji. 2. baskı, Springer-Verlag, 2013, ISBN 3-662-09182-8 , s. 110–117 ( Google kitap aramasında sınırlı önizleme )
- ↑ JM Pilewski, RA Frizzell: Havayolu hastalığında CFTR'nin rolü. İçinde: Fizyolojik incelemeler. Cilt 79, Sayı 1 Ek, Ocak 1999, s. S215-S255, PMID 9922383 (inceleme).
- ^ Albrecht Schwab: Solunum ve Asit-Baz Dengesi. İçinde: Michael Gekle et al. (Ed.): Cep ders kitabı Fizyoloji. Thieme Verlag, Stuttgart 2010, ISBN 978-3-13-144981-8 , s. 281.
- ↑ a b J. Zabner, JJ Smith ve diğerleri.: CFTR klorür kanallarının kaybı, in vitro olarak kistik fibroz hava yolu epiteli tarafından tuz emilimini değiştirir. İçinde: Moleküler hücre. Cilt 2, Sayı 3, Eylül 1998, sayfa 397-403, PMID 9774978 .
- ↑ a b J. J. Smith, SM Travis ve diğerleri: Kistik fibroz hava yolu epiteli, anormal hava yolu yüzey sıvısı nedeniyle bakterileri öldürmede başarısız olur. İçinde: Hücre. Cilt 85, Sayı 2, Nisan 1996, sayfa 229-236, PMID 8612275 .
- ↑ H. Matsui, BR Grubb ve ark .: Kistik fibrozis hava yolu hastalığının patogenezinde anormal iyon bileşimi değil, perisiliyer sıvı tabakası tükenmesi için kanıt. İçinde: Hücre. Cilt 95, Sayı 7, Aralık 1998, s. 1005-1015, PMID 9875854 .
- ↑ Geraldine Leier: Kistik fibroz ile ilgili olarak Sildenafil tarafından CFTR aktivasyonunun mekanizması. Tez, Westfälische Wilhelms-Universität Münster, 2011, s. 6.
- ↑ R. Tarran, BR Grubb ve diğerleri.: CF tuzu tartışması: in vivo gözlemler ve terapötik Yaklaşımlar. İçinde: Moleküler hücre. Cilt 8, Sayı 1, Temmuz 2001, sayfa 149-158, PMID 11511368 .
- ↑ WB Guggino: Kistik fibroz ve tuz tartışması. İçinde: Hücre. Cilt 96, Sayı 5, Mart 1999, s. 607-610, PMID 10089875 (inceleme).
- ↑ WB Guggino: Kistik fibrozis tuzu/sıvı tartışması: tam ortasında . İçinde: Doğa tıbbı. Cilt 7, Sayı 8, Ağustos 2001, sayfa 888-889, doi: 10.1038/90914 , PMID 11479614 .
- ↑ ME Krouse: Kistik fibroz akciğer hastalığı anormal iyon bileşiminden mi yoksa anormal hacimden mi kaynaklanır? İçinde: Genel fizyoloji Dergisi. Cilt 118, Sayı 2, Ağustos 2001, sayfa 219-222 , PMID 11479348 , PMC 2233826 (serbest tam metin) (inceleme).
- ↑ Andrew Bush: Kistik Fibrozis. İçinde: John A. Goodfellow (Ed.): Tıbbi Araştırmaları Anlamak: Tıbbı Şekillendiren Çalışmalar. John Wiley & Sons, 2012, ISBN 1-119-96373-7 , s. 88 Google kitap aramada sınırlı önizleme
- ↑ a b C. Randak, Burckhardt Tümmler: CFTR'nin plazma zarında bir klorür kanalı olarak işlevi. İçinde: Dietrich Reinhardt, Manfred Götz, Richard Kraemer, Martin H. Schöni (ed.): Kistik fibroz. Springer-Verlag, 2013, ISBN 978-3-642-56796-4 , s. 29–33 ( Google kitap aramada sınırlı önizleme ).
- ↑ K. Ho: ROMK-kistik fibroz transmembran iletkenlik düzenleyici bağlantı: ROMK ve kistik fibroz transmembran iletkenlik düzenleyici kanallar arasındaki ilişkiye dair yeni görüşler. İçinde: Nefroloji ve hipertansiyonda güncel görüş. Cilt 7, Sayı 1, Ocak 1998, s. 49-58, PMID 9442363 (inceleme).
- ↑ LC Boujaoude, C. Bradshaw-Wilder ve diğerleri: Kistik fibroz transmembran regülatörü, sfingoid baz fosfatların ve lizofosfatidik asidin alımını düzenler: sfingosin 1-fosfatın hücresel aktivitesinin modülasyonu. İçinde: Biyolojik Kimya Dergisi. Cilt 276, Sayı 38, Eylül 2001, sayfa 35258-35264, doi: 10.1074 / jbc.M105442200 , PMID 11443135 .
- ^ A b S.M. Rowe, S. Miller, EJ Sorscher: Kistik fibroz. İçinde: New England Tıp Dergisi . Cilt 352, Sayı 19, Mayıs 2005, sayfa 1992-2001, doi: 10.1056 / NEJMra043184 , PMID 15888700 .
- ↑ EF McKone, SS Emerson ve ark.: Kistik fibrozda genotipin fenotip ve mortalite üzerindeki etkisi: retrospektif bir kohort çalışması. İçinde: Lancet. Cilt 361, Sayı 9370, Mayıs 2003, sayfa 1671-1676, doi: 10.1016 / S0140-6736 (03) 13368-5 , PMID 12767731 .
- ↑ a b E. F. McKone, CH Goss, ML Aitken: kistik fibrozda bir prognoz belirleyicisi olarak CFTR genotipi. İçinde: Göğüs. Cilt 130, Sayı 5, Kasım 2006, sayfa 1441-1447, doi: 10.1378 / göğüs.130.5.1441 , PMID 17099022 .
- ^ EW Alton: Kistik fibrozisin hafif bir çeşidi. İçinde: Toraks. Cilt 51 Ek 2, Ağustos 1996, s. S51-S54, PMID 8869353 , PMC 1090707 (serbest tam metin) (inceleme).
- ↑ L. Cebotaru, D. Rapino ve diğerleri: Kistik fibroz hastalığı mutantının düzeltilmesi, A455E CFTR. İçinde: PloS bir. Cilt 9, 1 numaralı 2014, s E85183. Doi: 10,1371 / journal.pone.0085183 , PMID 24.416.359 , PMC 3.885.674 (serbest tam metin).
- ↑ a b c d e f M. P. Boyle, K. De Boeck: Kistik fibroz tedavisinde yeni bir dönem: altta yatan CFTR kusurunun düzeltilmesi. İçinde: Lancet. Solunum Yolu. Cilt 1, Sayı 2, Nisan 2013, sayfa 158-163, doi: 10.1016 / S2213-2600 (12) 70057-7 , PMID 24429096 (inceleme).
- ^ E. Kerem: Stop mutasyonları için farmakolojik tedavi: Ne kadar CFTR aktivitesi yeterlidir? İçinde: Akciğer tıbbında güncel görüş. Cilt 10, Sayı 6, Kasım 2004, s. 547-552, PMID 15510065 (inceleme).
- ↑ a b c Ernst Joachim Rietschel: Kistik fibroz: Semptomatikten tamamlayıcı mutasyona özgü tedaviye. Habilitasyon tezi, Köln Üniversitesi, 2013, s. 4.
- ↑ M. Haardt, M. Benharouga ve diğerleri.: C-terminal kesikleri , biyogenezini bozmadan kistik fibroz transmembran iletkenlik düzenleyicisini dengesizleştirir. Yeni bir mutasyon sınıfı. İçinde: Biyolojik Kimya Dergisi. Cilt 274, Sayı 31, Temmuz 1999, sayfa 21873-21877, PMID 10419506 .
- ↑ Marianne Abele-Horn: Antimikrobiyal Tedavi. Bulaşıcı hastalıkların tedavisi ve profilaksisi için karar desteği. Werner Heinz, Hartwig Klinker, Johann Schurz ve August Stich işbirliğiyle 2., gözden geçirilmiş ve genişletilmiş baskı. Peter Wiehl, Marburg 2009, ISBN 978-3-927219-14-4 , s. 193–197, burada: s. 193.
- ↑ Marianne Abele-Horn (2009), s. 195.
- ↑ Marianne Abele-Horn (2009), sayfa 193 ve (antimikrobiyal tedavi hakkında) sayfa 196.
- ↑ Dirk Stolz: Bir Alman hasta topluluğunda CFTR genindeki CFTRdele2,3 (21kb) mutasyonunun sıklığı üzerine. Tez, Justus Liebig Üniversitesi Giessen, 2006, s. 2.
- ↑ AM Cantin, G. Bilodeau ve diğerleri: Oksidan stres, CFTR ifadesini bastırır. İçinde: Amerikan fizyoloji dergisi. Hücre fizyolojisi. Cilt 290, Sayı 1, Ocak 2006, s. C262-C270, doi: 10.1152 / ajpcell.00070.2005 , PMID 16162662 .
- ↑ AM Cantin, JW Hanrahan ve ark.: Sigara içenlerde kistik fibroz transmembran iletkenlik düzenleyici işlevi baskılanır. İçinde: Amerikan solunum ve kritik bakım tıbbı dergisi. Cilt 173, Sayı 10, Mayıs 2006, sayfa 1139-1144, doi: 10.1164/rccm.200508-1330OC , PMID 16497995 .
- ↑ EF McKone, J. Shao ve diğerleri: Glutamat-sistein-ligaz genindeki varyantlar, kistik fibroz akciğer hastalığı ile ilişkilidir. İçinde: Amerikan solunum ve kritik bakım tıbbı dergisi. Cilt 174, sayı 4, Ağustos 2006, sayfa 415-419, doi: 10.1164 / rccm.200508-1281OC , PMID 16690975 , PMC 2648118 (serbest tam metin).
- ↑ a b T. O. Hirche, TOF Wagner: Mukoviszidose (kistik fibroz). İçinde: Heinrich Matthys, Werner Seeger: Klinik Pnömoloji. 4. baskı, Springer Science & Business Media, 2008, ISBN 3-540-37682-8 , s. 280-295 Google kitap aramasında kısıtlı önizleme
- ↑ J. Hein: Mukoviszidose (kistik fibroz). İçinde: Nikolaus Konietzko, H. Wendel, B. Wiesner: Akciğer hastalıkları. Walter de Gruyter, 1994 ISBN 3-11-012130-1 , s. 619 ( Google kitap aramasında sınırlı önizleme )
- ↑ a b M. Ballmann: Kistik fibroz ve diyabet. İçinde: Diyabetolog. Cilt 6, sayı 1, 2010, sayfa 16–22 doi: 10.1007 / s11428-009-0437-6 (ayrıca tip 3 diyabetin uzatılmış yaşam süresi için insülin tedavisine bakın ( sayfa artık mevcut değil , web arşivlerinde arama yapın ) Bilgi: Bağlantı otomatik olarak kusurlu olarak işaretlendi. Lütfen bağlantıyı talimatlara göre kontrol edin ve ardından bu bildirimi kaldırın. )
- ↑ J. Herwig, H. Böhles: Çocuklarda ve ergenlerde diyabet. İçinde: Hellmut Mehnert, Eberhard Standl ve diğerleri. (Ed.): Klinikte ve uygulamada diyabetoloji. 5. baskı, Georg Thieme Verlag, 2003, ISBN 3-13-512805-9 , s. 341 ( Google kitap aramada sınırlı önizleme )
- ↑ T. Flass, MR Narkewicz: Kistik fibrozda siroz ve diğer karaciğer hastalıkları. İçinde: Kistik fibroz Dergisi: Avrupa Kistik Fibrozis Derneği'nin resmi dergisi. Cilt 12, sayı 2, Mart 2013, s. 116-124, doi: 10.1016 / j.jcf.2012.11.010 , PMID 23266093 , PMC 3883947 (serbest tam metin).
- ↑ M. Angelico, C. Gandin ve ark.: Kistik fibrozda safra taşları: kritik bir yeniden değerlendirme. İçinde: Hepatoloji (Baltimore, Md.). Cilt 14, Sayı 5, Kasım 1991, s. 768-775, PMID 1937382 .
- ^ A b N. C. Dean, DH Van Boerum, TG Liou: Kistik fibrozlu bir erişkinde akut ve subakut kaynama olmayan kaburga kırıklarının kaburga kaplaması: bir vaka sunumu. İçinde: BMC araştırma notları. Cilt 7, 2014, sayfa 681, doi: 10.1186 / 1756-0500-7-681 , PMID 25270323 , PMC 4197343 (serbest tam metin).
- ↑ a b c d e f g R. M. Javier, J. Jacquot: Kistik fibrozda kemik hastalığı: Yeni ne var? İçinde: Eklem, kemik, omurga. Cilt 78, Sayı 5, Ekim 2011, s. 445-450, doi: 10.1016 / j.jbspin.2010.11.015 , PMID 21233000 (inceleme).
- ↑ a b L. S. Conwell, AB Chang: Kistik fibrozlu kişilerde osteoporoz için bifosfonatlar. İçinde: Sistematik incelemelerin Cochrane veritabanı. Cilt 3, 2014, S. CD002010, doi: 10.1002 / 14651858.CD002010.pub4 , PMID 24627308 (İnceleme).
- ^ G. Döring, SP Conway: Kistik fibrozda osteoporoz. İçinde: Jornal de pediatria. Cilt 84, Sayı 1, 2008, sayfa 1-3, doi: 10.2223 / JPED.1749 , PMID 18264617 .
- ↑ CS Haworth, PL Selby ve ark.: Kistik fibrozlu erişkinlerde osteoporoz. İçinde: Kraliyet Tıp Derneği Dergisi. Cilt 91 Ek 34, 1998, s. 14-18, PMID 9709383 , PMC 1296368 (serbest tam metin) (inceleme).
- ↑ a b R. M. Aris, JB Renner ve ark.: Artan kırık ve şiddetli kifoz oranı: kistik fibrozlu yetişkinliğe yaşamanın sekelleri. İçinde: Annals of Internal Medicine. Cilt 128, Sayı 3, Şubat 1998, s. 186-193, PMID 9454526 .
- ↑ SM Lang, R. Fischer ve ark.: Kistik fibrozlu erişkin hastalarda yüksek osteoporoz prevalansı. In: Alman Tıp Haftası (1946). Cilt 129, Sayılar 28-29, Temmuz 2004, s. 1551-1555, doi: 10.1055/s-2004-828988 , PMID 15243902 .
- ↑ EF Shead, CS Haworth ve ark.: Kistik fibrozun enfektif alevlenmeleri sırasında osteoklast fonksiyonu, kemik döngüsü ve inflamatuar sitokinler. İçinde: Kistik fibroz dergisi. Cilt 9, Sayı 2, Mart 2010, sayfa 93-98, doi: 10.1016 / j.jcf.2009.111.007 , PMID 20006563 .
- ↑ EF Shead, CS Haworth ve ark.: Kistik fibrozlu hastalarda enfektif alevlenmeler sırasında osteoklastogenez. İçinde: Amerikan solunum ve kritik bakım tıbbı dergisi. Cilt 174, Sayı 3, Ağustos 2006, sayfa 306-311, doi: 10.1164 / rccm.200512-1943OC , PMID 16675777 .
- ↑ EF Shead, CS Haworth ve diğerleri: Kistik fibroz transmembran iletkenlik düzenleyici (CFTR) insan kemiğinde ifade edilir. İçinde: Toraks. Cilt 62, sayı 7, Temmuz 2007, sayfa 650-651, doi: 10.1136 / thx.2006.075887 , PMID 17600296 , PMC 2117234 (serbest tam metin).
- ↑ L. Le Heron, C. Guillaume ve diğerleri: Kistik fibroz transmembran iletkenlik düzenleyici (CFTR), insan kemiğinde osteoprotegerin (OPG) ve prostaglandin (PG) E2 üretimini düzenler. İçinde: Kistik fibroz dergisi. Cilt 9, Sayı 1, Ocak 2010, sayfa 69-72, doi: 10.1016 / j.jcf.2009.11.005 , PMID 20005786 .
- ↑ E. Shane, SJ Silverberg ve ark.: Son dönem akciğer hastalığı olan akciğer transplantasyonu adaylarında osteoporoz. İçinde: Amerikan tıp dergisi. Cilt 101, Sayı 3, Eylül 1996, sayfa 262-269, doi: 10.1016 / S0002-9343 (96) 00155-6 , PMID 8873487 .
- ↑ RZ Sokol: Kistik fibrozlu erkeklerde kısırlık. İçinde: Akciğer tıbbında güncel görüş. Cilt 7, Sayı 6, Kasım 2001, s. 421-426, PMID 11706320 (inceleme).
- ↑ W. Lissens, I. Liebaers: Kistik fibroz ile ilişkili erkek kısırlığının genetiği. İçinde: Baillière'in klinik obstetrik ve jinekolojisi. Cilt 11, Sayı 4, Aralık 1997, s. 797-817, PMID 9692018 (inceleme).
- ↑ J. Yu, Z. Chen ve diğerleri: Konjenital bilateral vas deferens yokluğu olan erkeklerde CFTR mutasyonları (CBAVD): sistemik bir inceleme ve meta-analiz. İçinde: İnsan üremesi. Cilt 27, Sayı 1, Ocak 2012, sayfa 25-35, doi: 10.1093 / humrep / der377 , PMID 22081250 (inceleme).
- ^ Bir b c d Gerhard Dockter Hermann Lindemann: Genetik, moleküler biyoloji ve genel patofizyolojisi. İçinde: Hermann Lindemann, Burckhardt Tümmler, Gerhard Dockter (ed.): Mukoviszidose - kistik fibroz. 4. baskı, Georg Thieme, 2004, ISBN 3-13-138604-5 , s. 3-13, Google kitap aramasında sınırlı önizleme
- ↑ Olaf Sommerburg: Kistik fibroz: korkunç sonuçları olan genetik bozukluk. İçinde: pharmische-zeitung.de. 2008, 16 Mart 2015'te erişildi .
- ^ A b Claus Kroegel Ulrich Costabel: Klinik Pnömoloji: klinikler ve uygulamalarda referans çalışmaları. Georg Thieme, 2013, ISBN 3-13-175781-7 , s. 655 Google kitap aramasında sınırlı önizleme
- ↑ MJ Müller, J. Westenhöfer ve diğerleri: Beslenmeyle ilgili tıbbi muayeneler. İçinde: Manfred James Müller: Beslenme Tıbbı Uygulaması: Yöntemler - Önleme - Tedavi. 2. baskı, Springer-Verlag, 2007, ISBN 3-540-38231-3 , s. 162 Google kitap aramasında kısıtlı önizleme
- ^ J. Massie, B. Clements: Yenidoğan taramasından sonra kistik fibroz teşhisi: Avustralasya deneyimi - yirmi yıl ve beş milyon bebek sonra: Avustralasyalı Pediatrik Solunum Grubundan bir fikir birliği beyanı. İçinde: Pediatrik pulmonoloji. Cilt 39, sayı 5, Mayıs 2005, sayfa 440-446, doi: 10.1002 / ppul.20191 , PMID 15704202 (inceleme).
- ↑ Corina S. Rueegg, Claudia E. Kuehni, Sabina Gallati, Matthias Baumgartner, Toni torresani, Juerg Barben: İsviçre'de kistik fibroz için yenidoğan taraması: Bir yıl sonra değerlendirme . İçinde: Deutsches Ärzteblatt . bant 110 , hayır. 20 . Deutscher Ärzte-Verlag , 17 Mayıs 2013, s. 356–63 , doi : 10.3238 / arztebl.2013.0356 .
- ↑ Kistik Fibrozis: Kuzeydoğuda Yenidoğan Taraması. İçinde: aerztezeitung.de. 12 Ekim 2012, erişim tarihi 16 Mart 2015 .
- ↑ B. Sens, M. Stern (Ed.): Rapor sayısı: Kistik fibroz için kalite güvencesi 2012 ( sayfa artık mevcut değil , web arşivlerinde arama yapın ) Bilgi: Bağlantı otomatik olarak kusurlu olarak işaretlendi. Lütfen bağlantıyı talimatlara göre kontrol edin ve ardından bu uyarıyı kaldırın. Hipokampus Verlag, ISBN 978-3-88579-906-1 , s.39 .
- ↑ a b M. Stopsack, J. Hammermann: Kistik fibroz için yenidoğan taraması. İçinde: Aylık Pediatri. Cilt 157, sayı 12, sayfa 1222-1229 doi: 10.1007 / s00112-009-2042-6
- ↑ Lutz Nahrlich, Klaus-Peter Zimmer: Kistik Fibrozis için Yenidoğan Taraması: Başlayalım! İçinde: Deutsches Ärzteblatt . bant 110 , hayır. 20 . Deutscher Ärzte-Verlag , 17 Mayıs 2013, s. 354-5 , doi : 10.3238 / arztebl.2013.0354 .
- ↑ Ingeborg Bördlein: Konjenital metabolik hastalıklar: uzun süreli çalışma yenidoğan taramasının faydasını kanıtlıyor . İçinde: Deutsches Ärzteblatt . bant 108 , hayır. 36 . Deutscher Ärzte-Verlag , 9 Eylül 2011, s. A-1855 / B-1581 / C-1570 .
- ↑ Erik Harms, Bernhard Olgemöller: Metabolik hastalıklar ve endokrinopatiler için yenidoğan taraması . İçinde: Deutsches Ärzteblatt . bant 108 , hayır. 1-2 . Deutscher Ärzte-Verlag , 10 Ocak 2011, s. 11–22 , doi : 10.3238 / arztebl.2011.0011 .
- ↑ Udo Wendel, Martin Lindner, Markus Bettendorf: Almanya'da yenidoğan taraması. Schattauer Verlag, 2009, ISBN 3-7945-2686-4 , s. 78 Google kitap aramasında sınırlı önizleme
- ↑ Deutsches Ärzteblatt 33/34, 21 Ağustos 2017
- ^ DS Hardin: Kistik fibrozlu çocuklarda büyüme sorunları ve büyüme hormonu tedavisi. İçinde: Pediatrik endokrinoloji ve metabolizma dergisi. Cilt 15 Ek 2, Mayıs 2002, sayfa 731-735, PMID 12092687 (inceleme).
- ↑ a b c d Tom O. Hirche, Thomas OF Wagner: Mukoviszidose Güncellemesi. Georg Thieme Verlag, 2013, ISBN 978-3-13-176981-7 , s. 11-21 ( Google kitap aramada sınırlı önizleme )
- ↑ Marianne Abele-Horn (2009), s. 193 ve 195.
- ↑ DGPI kılavuzu. Georg Thieme Verlag, 2013, ISBN 978-3-13-166546-1 , s. 460 ( Google kitap aramada sınırlı önizleme ).
- ↑ Peter Hien: Pratik Pnömoloji. Bölüm 56: Kistik Fibrozis. 2. baskı, Springer-Verlag, 2011, ISBN 3-642-10209-3 , s. 185 ( Google kitap aramada sınırlı önizleme )
- ↑ Christine Vetter: Kistik fibrozlu kişiler için DNaz: akciğer fonksiyonu önemli ölçüde iyileşir . İçinde: Deutsches Ärzteblatt . bant 91 , hayır. 47 . Deutscher Ärzte-Verlag , 25 Kasım 1994, s. A-3302 .
- ↑ DS Hardin, C. Ahn ve ark.: Büyüme hormonu, kistik fibrozlu çocuklarda kemik mineral içeriğini iyileştirir. İçinde: Pediatrik endokrinoloji ve metabolizma dergisi. Cilt 18, Sayı 6, Haziran 2005, s. 589-595, PMID 16042327 .
- ^ V. Teichgräber, M. Ulrich ve diğerleri: Seramid birikimi, kistik fibrozda iltihaplanma, hücre ölümü ve enfeksiyon duyarlılığına aracılık eder. İçinde: Doğa tıbbı. Cilt 14, Sayı 4, Nisan 2008, sayfa 382-391, doi: 10.1038/nm1748 , PMID 18376404 .
- ↑ Kistik fibroz için yeni tedavi. İçinde: science.orf.at. 30 Mart 2008, erişim tarihi 6 Mart 2015 .
- ↑ J. Kornhuber, M. Muehlbacher ve diğerleri: Asit sfingomiyelinazın yeni fonksiyonel inhibitörlerinin tanımlanması. İçinde: PloS bir. Cilt 6, 8 numara, 2011, s E23852. Doi: 10,1371 / journal.pone.0023852 , PMID 21909365 , PMC 3166082 (ücretsiz tam metin).
- ^ TG Liou, FR Adler ve ark.: Kistik fibrozlu çocuklarda akciğer transplantasyonu ve sağkalım. İçinde: New England Tıp Dergisi . Cilt 357, Sayı 21, Kasım 2007, s. 2143-2152, doi: 10.1056 / NEJMoa066359 , PMID 18032764 , PMC 2522236 (serbest tam metin).
- ↑ Peter Hien: Pratik Pnömoloji. Bölüm 56: Kistik Fibrozis. 2. baskı, Springer-Verlag, 2011, ISBN 3-642-10209-3 , s. 479-484 ( Google kitap aramasında sınırlı önizleme )
- ↑ a b E. M. Welch, ER Barton ve diğerleri: PTC124, anlamsız mutasyonların neden olduğu genetik bozuklukları hedefler. İçinde: Doğa. Cilt 447, sayı 7140, Mayıs 2007, s. 87-91, doi: 10.1038 / nature05756 , PMID 17450125 .
- ↑ GL McPhail, JP Clancy: Ivacaftor: kistik fibrozisin birincil nedenine etki eden ilk tedavi. İçinde: Günümüzün Uyuşturucuları. Cilt 49, sayı 4, Nisan 2013, s. 253-260, doi: 10.1358 / dot.2013.49.4.1940984 , PMID 23616952 .
- ↑ FDA, Kalydeco'nun nadir görülen kistik fibroz formunu tedavi etmesini onayladı. İçinde: fda.gov. 31 Ocak 2012, erişim tarihi 2 Mart 2015 .
- ↑ Kalydeco - ivacaftor. İçinde: ema.europa.eu. 6 Ağustos 2012, 2 Mart 2015'te erişildi .
- ↑ Halk için EPAR'ın özeti: Kalydeco - Ivacaftor. Avrupa İlaç Ajansı, Temmuz 2014 (PDF dosyası; 61 kB)
- ↑ K. Kotha, JP Clancy: G551D mutasyonlu kistik fibroz hastalarının Ivacaftor tedavisi: kanıtların gözden geçirilmesi. İçinde: Solunum hastalığında terapötik gelişmeler. Cilt 7, Sayı 5, Ekim 2013, s. 288-296, doi: 10.1177 / 1753465813502115 , PMID 24004658 (inceleme).
- ↑ I. Sermet-Gaudelus: Kistik fibrozlu ve G551D-CFTR mutasyonlu hastalarda Ivacaftor tedavisi. In: Avrupa solunum incelemesi. Cilt 22, sayı 127, Mart 2013, s. 66-71, doi: 10.1183 / 09059180.00008512 , PMID 23457167 (inceleme).
- ↑ a b c rme / aerzteblatt.de: Kistik fibroz: Ivacaftor Avrupa'da onaylanmıştır. İçinde: aerzteblatt.de . 27 Temmuz 2012, 6 Mart 2015'te erişildi .
- ↑ a b muko.info: Ivacaftor (Kalydeco®; VX-770) Almanya'da onaylanmıştır. İçinde: muko.info. 29 Kasım 2012, orijinalinden 2 Nisan 2015'te arşivlendi ; 6 Mart 2015 tarihinde erişildi .
- ^ A b Andrew Pollack: FDA Yeni Kistik Fibrozis İlacını Onayladı. In: nytimes.com. 31 Ocak 2012, erişim tarihi 6 Mart 2015 .
- ↑ a b Yeni İlaçlar 2012/2013 - kritik bir değerlendirme kritik bir değerlendirme. Alman Tabipler Birliği Alman İlaç Komisyonu tarafından Saksonya-Anhalt ve KV Saksonya-Anhalt Tıp Birliği ile birlikte 27 Nisan 2013 tarihinde Halle'de (Saale) düzenlenen bir eğitim etkinliğinde konferans; (PDF dosyası)
- ↑ N. Derichs: Genetik bir kusurun hedeflenmesi: kistik fibrozda kistik fibroz transmembran iletkenlik düzenleyici modülatörleri. In: Avrupa solunum incelemesi. Cilt 22, sayı 127, Mart 2013, sayfa 58-65, doi: 10.1183 / 09059180.00008412 , PMID 23457166 (inceleme makalesi, tamamına ücretsiz olarak erişilebilir).
- ↑ N. Lenherra, L. Krueger ve diğerleri: Ivacaftor - kistik fibrozun nedensel tedavisi için ilk ilaç. In: İsviçre Med Forumu. Cilt 14, sayı 43, 2014, s. 799-801.
- ^ ABD Gıda ve İlaç Dairesi, Kistik Fibrozise Neden Olan Sekiz Ek Mutasyonda Kullanım İçin KALYDECO™ (ivacaftor) Onayladı. İçinde: yatırımcılar.vrtx.com. 21 Şubat 2014, erişim tarihi 29 Mart 2015 .
- ↑ Rüdiger Meyer: kistik fibroz. Üçlü bir terapi oldukça etkilidir ve iki yönlü kombinasyondan daha üstündür. İçinde: Deutsche Ärzteblatt. Cilt 116, Sayı 49, 6 Aralık 2019, SB 1892.
- ↑ JC Davies, EW Alton: KF hastalarında gen tedavisi denemelerinin tasarımı. İçinde: Moleküler biyolojide yöntemler (Clifton, NJ). Cilt 741, 2011, s. 55-68, doi: 10.1007 / 978-1-61779-117-8_5 , PMID 21594778 (inceleme).
- ↑ a b M. Wilschanski: Kistik fibroz için yeni terapötik yaklaşımlar. İçinde: Keşif tıbbı. Cilt 15, Sayı 81, Şubat 2013, s. 127-133, PMID 23449115 (inceleme).
- ↑ I. Sermet-Gaudelus, KD Boeck ve diğerleri.: Ataluren (PTC124), anlamsız mutasyonlu kistik fibrozlu çocuklarda kistik fibrozis transmembran iletkenlik düzenleyici protein ekspresyonunu ve aktivitesini indükler. İçinde: Amerikan solunum ve kritik bakım tıbbı dergisi. Cilt 182, Sayı 10, Kasım 2010, sayfa 1262-1272, doi: 10.1164/rccm.201001-0137OC , PMID 20622033 .
- ↑ Klinik çalışma (faz III): NIH'nin Clinicaltrials.gov adresinde Nonsense Mutation Kistik Fibrozis'te (ACT CF) Ataluren Çalışması
- ↑ MP Boyle, SC Bell ve diğerleri .: phe508del CFTR mutasyonu olan kistik fibrozlu hastaların tedavisi için bir CFTR düzeltici (lumacaftor) ve bir CFTR güçlendirici (ivacaftor): bir faz 2 randomize kontrollü çalışma İçinde: Lancet. Solunum Yolu. Cilt 2, Sayı 7, Temmuz 2014, sayfa 527-538, doi: 10.1016 / S2213-2600 (14) 70132-8 , PMID 24973281 .
- ↑ Klinik Çalışma : (Faz III) Denekler 12 Yıl Ivacaftor birlikte Lumacaftor A Faz 3 Devrilen Etüdü ve Yaşlı ile Kistik Fibrozis de arasında ClinicalTrials.gov NIH
- ↑ T. Iannitti, B. Palmieri: Sodyum fenilbütiratın klinik ve deneysel uygulamaları. İçinde: Ar-Ge'de İlaçlar. Cilt 11, sayı 3, Eylül 2011, s. 227-249, doi: 10.2165 / 11591280-000000000-00000 , PMID 21902286 , PMC 3586072 (serbest tam metin) (inceleme).
- ^ PL Zeitlin, M. Diener-West ve diğerleri: 4-fenilbutiratın sistemik uygulamasından sonra kistik fibrozda CFTR fonksiyonunun kanıtı. İçinde: Moleküler terapi. Cilt 6, sayı 1, Temmuz 2002, sayfa 119-126 , doi: 10.1006 / mthe.2002.0639 , PMID 12095312 .
- ↑ Ammonaplar - Ek I: Ürün Özelliklerinin Özeti. sayfa 4-5.
- ↑ Klinik çalışma (faz I): Delta F508-Heterozigotlarda (Kistik Fibrozis için) Fenilbutirat / Genistein Duoterapisi , NIH Clinicaltrials.gov adresinde
- ↑ Klinik çalışma (faz I + II): 'En ClinicalTrials.gov NIH
- ↑ a b Yetim tanımına ilişkin genel görüş özeti: kistik fibroz tedavisi için 4,6,4'-Trimetilanjelisin. Yetim Tıbbi Ürünler Komitesi, 8 Temmuz 2013
- ↑ M. Favia, MT Mancini ve diğerleri.: Trimetilanjelisin, kistik fibroz hava yolu hücrelerinde mutant F508del CFTR proteininin işlevsel kurtarılmasını destekler. İçinde: Amerikan fizyoloji dergisi. Akciğer hücresel ve moleküler fizyolojisi. Cilt 307, sayı 1, Temmuz 2014, s. L48-L61, doi: 10.1152 / ajplung.00305.2013 , PMID 24816489 .
- ↑ JF Collawn, L. Fu ve diğerleri: ΔF508 CFTR'yi çift etkili bir düzeltici ve güçlendirici olan trimetilanjelisin ile kurtarmak. İçinde: Amerikan fizyoloji dergisi. Cilt 307, sayı 6, Eylül 2014, s. L431 – L434, doi: 10.1152 / ajplung.00177.2014 , PMID 25063802 , PMC 4166784 (serbest tam metin) (inceleme).
- ↑ a b c T. S. Cohen, A. Prince: Kistik fibroz: mukozal immün yetmezlik sendromu. İçinde: Doğa tıbbı. Cilt 18, sayı 4, Nisan 2012, s. 509-519, doi: 10.1038 / nm.2715 , PMID 22481418 , PMC 3577071 (serbest tam metin) (inceleme).
- ↑ LL Clarke, BR Grubb ve diğerleri: Gen hedefli bir fare kistik fibroz modelinde kusurlu epitelyal klorür taşınması. İçinde: Bilim. Cilt 257, Sayı 5073, Ağustos 1992, sayfa 1125-1128, PMID 1380724 .
- ↑ JN Snouwaert, KK Brigman ve diğerleri: Gen hedeflemesi ile yapılan kistik fibroz için bir hayvan modeli. İçinde: Bilim. Cilt 257, Sayı 5073, Ağustos 1992, sayfa 1083-1088, PMID 1380723 .
- ↑ R. Rozmahel, M. Wilschanski ve diğerleri: Kistik fibroz transmembran iletkenlik düzenleyicisi eksik farelerde ikincil bir genetik faktör ile hastalık şiddetinin modülasyonu. İçinde: Doğa genetiği. Cilt 12, Sayı 3, Mart 1996, sayfa 280-287, doi: 10.1038/ng0396-280 , PMID 8589719 .
- ↑ CS Rogers, Y. Hao ve diğerleri: Adeno-ilişkili virüs aracılı gen hedefleme ve somatik hücre nükleer transferi ile CFTR-null ve CFTR-DeltaF508 heterozigot domuzların üretimi. İçinde: Klinik Araştırma Dergisi. Cilt 118, sayı 4, Nisan 2008, sayfa 1571-1577, doi: 10.1172 / JCI34773 , PMID 18324337 , PMC 2265103 (serbest tam metin).
- ↑ LS Ostedgaard, DK Meyerholz ve diğerleri: ΔF508 mutasyonu, domuzlarda CFTR yanlış işlemesine ve kistik fibroz benzeri hastalığa neden olur. İçinde: Bilim Çeviri Tıbbı . Cilt 3, sayı 74, Mart 2011, sayfa 74ra24, doi: 10.1126 / scitranslmed.3001868 , PMID 21411740 , PMC 3119077 (serbest tam metin).
- ↑ DA Stoltz, DK Meyerholz ve diğerleri: Kistik fibroz domuzları, doğumda akciğer hastalığı geliştirir ve kusurlu bakteriyel eradikasyon sergiler. İçinde: Bilim Çeviri Tıbbı . Cilt 2, sayı 29, Nisan 2010, sayfa 29ra31, doi: 10.1126 / scitranslmed.3000928 , PMID 20427821 , PMC 2889616 (serbest tam metin).
- ↑ Y. Song, W. Namkung ve diğerleri.: Domuz ve insan trakeasının ex vivo fragmanlarında ölçülen hava yolu yüzey sıvı derinliği: Na+ ve Cl-kanal fonksiyonuna bağımlılık. İçinde: Amerikan fizyoloji dergisi. Akciğer hücresel ve moleküler fizyolojisi. Cilt 297, sayı 6, Aralık 2009, s. L1131 – L1140, doi: 10.1152 / ajplung.00085.2009 , PMID 19820035 , PMC 2793186 (serbest tam metin).
- ↑ X. Sun, H. Sui ve diğerleri: Kistik fibrozun bir gelincik CFTR nakavt modelinin hastalık fenotipi. İçinde: Klinik Araştırma Dergisi. Cilt 120, sayı 9, Eylül 2010, sayfa 3149-3160, doi: 10.1172 / JCI43052 , PMID 20739752 , PMC 2929732 (serbest tam metin).
- ^ NW Keizer, JF Engelhardt: Kistik fibrozun yeni hayvan modelleri: bize ne öğretiyorlar? İçinde: Akciğer tıbbında güncel görüş. Cilt 17, sayı 6, Kasım 2011, s. 478-483, doi: 10.1097 / MCP.0b013e32834b14c9 , PMID 21857224 , PMC 3596000 (serbest tam metin) (inceleme).
- ^ PB Davis: 1938'den beri kistik fibroz. İçinde: Amerikan solunum ve kritik bakım tıbbı dergisi. Cilt 173, Sayı 5, Mart 2006, sayfa 475-482, doi: 10.1164 / rccm.200505-840OE , PMID 16126935 (inceleme).
- ^ JA Dodge, PA Lewis ve diğerleri: Birleşik Krallık'ta kistik fibroz mortalitesi ve sağkalım: 1947-2003. İçinde: Avrupa solunum dergisi. Cilt 29, Sayı 3, Mart 2007, sayfa 522-526, doi: 10.1183/09031936.00099506 , PMID 17182652 .
- ↑ LK Tuchman, LA Schwartz ve diğerleri: Kistik fibroz ve yetişkin tıbbi bakımına geçiş. İçinde: Pediatri. Cilt 125, sayı 3, Mart 2010, sayfa 566-573, doi: 10.1542 / peds.2009-2791 , PMID 20176665 (inceleme).
- ↑ Irmgard Eichler: Kistik fibroz (kistik fibroz). İçinde: Christian P. Speer, Manfred Gahr (Ed.): Pediatri. Springer-Verlag, 2013, ISBN 3-662-09178-X , s. 558-565, Google kitap aramasında sınırlı önizleme
- ^ JL Kreindler, VA Miller: Kistik fibroz: pediatrik sağlıktan yetişkin odaklı sağlık bakımına geçişi ele almak. İçinde: Hasta tercihi ve bağlılık. Cilt 7, 2013, s. 1221-1226, doi: 10.2147 / PPA.S37710 , PMID 24376344 , PMC 3864992 (serbest tam metin) (inceleme).
- ↑ BS Quon, WD Bentham ve ark.: PHQ-9 ve GAD-7 Tarama Anketlerine Dayalı Kistik Fibrozisli Erişkinlerde Depresyon ve Anksiyete Semptomlarının Prevalansı. İçinde: Psikosomatik. [baskı öncesi elektronik yayın] Haziran 2014, doi: 10.1016 / j.psym.2014.05.017 , PMID 25556569 .
- ↑ N. Sharer, M. Schwarz ve diğerleri: Kronik pankreatitli hastalarda kistik fibroz geninin mutasyonları. İçinde: New England Tıp Dergisi . Cilt 339, Sayı 10, Eylül 1998, sayfa 645-652, doi: 10.1056 / NEJM199809033391001 , PMID 9725921 .
- ↑ JA Cohn, KJ Friedman ve ark.: Kistik fibroz geninin mutasyonları ile idiyopatik pankreatit arasındaki ilişki. İçinde: New England Tıp Dergisi . Cilt 339, Sayı 10, Eylül 1998, sayfa 653-658, doi: 10.1056 / NEJM199809033391002 , PMID 9725922 .
- ↑ Tilman Horn: Hiperparatiroidili hastalarda pankreatit: SPINK1 ve CFTR genindeki mutasyonlarla ilişki Tez, Ruhr Üniversitesi Bochum, Tıp Fakültesi, 2009, s. 47.
- ^ JO Warner, AP Norman, JF Soothill: Alerji patogenezinde kistik fibroz heterozigotluğu. İçinde: Lancet. Cilt 1, Sayı 7967, Mayıs 1976, sayfa 990-991, PMID 57442 .
- ↑ M. Dahl, A. Tybjaerg-Hansen ve diğerleri: DeltaF508 kistik fibrozda heterozigotluk ve astıma yatkınlık. İçinde: Lancet. Cilt 351, Sayı 9120, Haziran 1998, s. 1911-1913, PMID 9654257 .
- ↑ C. Lázaro, R. de Cid ve ark .: Yetişkin astımlı hastalarda kistik fibroz genindeki hatalı mutasyonlar. İçinde: İnsan mutasyonu. Cilt 14, Sayı 6, 1999, sayfa 510-519, doi : 10.1002 / (SICI) 1098-1004 (199912) 14: 6 <510 :: AID-HUMU10> 3.0.CO;2O , PMID 10571949 .
- ↑ SA Schroeder, DM Gaughan, M. Swift: CFTR delta F508 mutasyonu ile bronşiyal astıma karşı koruma: kistik fibrozda heterozigot bir avantaj. İçinde: Doğa tıbbı. Cilt 1, Sayı 7, Temmuz 1995, sayfa 703-705, PMID 7585155 .
- ↑ N. Maurya, S. Awasthi, P. Dixit: Bronşiyal astım ile CFTR gen mutasyonu ilişkisi. In: Hint tıbbi araştırma dergisi. Cilt 135, Sayı 4, Nisan 2012, sayfa 469-478, PMID 22664493 , PMC 3385229 (serbest tam metin) (inceleme).
- ↑ a b T. A. VanWort, JA Lee ve diğerleri.: Kadın kistik fibroz mutasyon taşıyıcıları ve yardımcı üreme teknolojisi: taşıyıcılık durumu üreme sonuçlarını etkiler mi? İçinde: Doğurganlık ve kısırlık. Cilt 102, sayı 5, Kasım 2014, sayfa 1324-1330, doi: 10.1016 / j.fertnstert.2014.07.1234 , PMID 25217870 .
- ^ A b I. Gallego Romero, C. Ober: Bir popülasyon izolatında CFTR mutasyonları ve üreme sonuçları. İçinde: İnsan genetiği. Cilt 122, Sayı 6, Ocak 2008, sayfa 583-588, doi: 10.1007 / s00439-007-0432-1 , PMID 17901983 .
- ↑ M. Dahl, A. Tybjaerg-Hansen ve diğerleri: Kistik fibroz Delta F508 heterozigotları, sigara içme ve üreme: genel popülasyon örneğinden 9141 birey üzerinde yapılan çalışmalar. İçinde: Genomik. Cilt 50, sayı 1, Mayıs 1998, sayfa 89-96 , doi: 10.1006 / geno.1998.5272 , PMID 9628826 .
- ^ SV Raju, JH Tate ve ark.: Kronik bronşitli KOAH hastalarında heterozigot CFTR mutasyonlarının etkisi. İçinde: Solunum araştırması. Cilt 15, 2014, sayfa 18, doi: 10.1186 / 1465-9921-15-18 , PMID 24517344 , PMC 3925354 (serbest tam metin).
- ↑ CR Lake, PB Davis ve ark.: Kistik fibrozlu hastaların kanındaki elektrolitler ve norepinefrin seviyeleri. İçinde: Clinica Chimica Acta . Cilt 92, Sayı 2, Mart 1979, sayfa 141-146, PMID 487568 .
- ↑ a b c M. Super, A. Irtiza-Ali ve ark.: Kan basıncı ve kistik fibroz geni: Kadın taşıyıcılarda yaşla birlikte düşük basıncın arttığına dair kanıt. İçinde: Hipertansiyon. Cilt 44, Sayı 6, Aralık 2004, s. 878-883, doi: 10.1161 / 01.HYP.0000145901.81989.46 , PMID 15477385 .
- ↑ J. Lieberman, S. Rodbard: Kistik fibrozlu genç erişkinlerde düşük kan basıncı: terde kronik tuz kaybının bir etkisi mi? İçinde: Annals of Internal Medicine. Cilt 82, Sayı 6, Haziran 1975, sayfa 806-808, PMID 1138590 .
- ↑ JJ Guo, DA Stoltz ve diğerleri: Kistik fibroz domuz yavrularında vasküler düz kas hücre fonksiyonunda genotipe özgü değişiklikler. İçinde: Kistik fibroz dergisi. Cilt 13, sayı 3, Mayıs 2014, s. 251-259, doi: 10.1016 / j.jcf.2013.10.009 , PMID 24183914 , PMC 3972271 (serbest tam metin).
- ↑ VA Peotta, P. Bhandary ve diğerleri.: CFTR-F508del taşıyıcılarının düşük kan basıncı, farelerde dolaşan kan hacminden ziyade azalmış arteriyel reaktivite ile ilişkilidir. İçinde: PloS bir. Cilt 9, sayı 5, 2014 sayfa E96756. Doi: 10,1371 / journal.pone.0096756 , PMID 24.801.204 , PMC 4.011.854 (serbest tam metin).
- ↑ N. Morral, V. Nunes ve diğerleri: Kistik fibroz için mikro uydu haplotipleri: mutasyon çerçeveleri ve evrimsel izleyiciler. İçinde: İnsan moleküler genetiği. Cilt 2, Sayı 7, Temmuz 1993, s. 1015-1022, PMID 7689896 .
- ↑ S. Rendine, F. Calafell u a. .: İtalya'da kistik fibroz mutasyonlarının genetik tarihi. I. Bölgesel dağıtım. İçinde: Annals of Human Genetics. Cilt 61, 1997, sayfa 411-424, doi: 10.1046 / j.1469-1809.1997.6150411.x , PMID 9459003 .
- ↑ C. Wiuf: Delta F508 heterozigotlarının seçici bir avantajı var mı? İçinde: Genetik araştırma. Cilt 78, Sayı 1, Ağustos 2001, sayfa 41-47, PMID 11556136 .
- ↑ Heike Bickeböller, Christine Fischer: Genetik Epidemiyolojiye Giriş. Springer-Verlag, 2007, ISBN 3-540-33568-4 , s. 73 Google kitap aramasında sınırlı önizleme
- ^ M. Claustres: Erkek kısırlığında CFTR lokusunun moleküler patolojisi. İçinde: Çevrimiçi üreme biyotıbbı. Cilt 10, Sayı 1, Ocak 2005, s. 14-41 , PMID 15705292 (inceleme).
- ^ SE Gabriel, KN Brigman ve diğerleri: Kistik fibroz fare modelinde kolera toksinine karşı kistik fibroz heterozigot direnci. İçinde: Bilim. Cilt 266, Sayı 5182, Ekim 1994, sayfa 107-109, PMID 7524148 .
- ↑ GB Pier, M. Grout ve diğerleri: Salmonella typhi, bağırsak epitel hücrelerine girmek için CFTR kullanır. İçinde: Doğa. Cilt 393, Sayı 6680, Mayıs 1998, sayfa 79-82, doi: 10.1038/30006 , PMID 9590693 .
- ↑ JB Lyczak, GB İskele: Salmonella enterica serovar typhi, bağırsak epiteli üzerindeki kistik fibroz transmembran iletkenlik düzenleyicisi olan reseptörünün hücre yüzeyi ekspresyonunu modüle eder. İçinde: Enfeksiyon ve Bağışıklık. Cilt 70, Sayı 11, Kasım 2002, s. 6416-6423, PMID 12379722 , PMC 130400 (serbest tam metin).
- ↑ E. van de Vosse, S. Ali ve diğerleri.: Tifo ateşine duyarlılık, kistik fibroz transmembran iletkenlik düzenleyicideki (CFTR) bir polimorfizm ile ilişkilidir. İçinde: İnsan genetiği. Cilt 118, Sayı 1, Ekim 2005, sayfa 138-140, doi: 10.1007 / s00439-005-0005-0 , PMID 16078047 .
- ↑ E. van de Vosse, AW de Visser ve ark.: Bir Endonezya enterik ateş kohortunda CFTR varyasyonlarının dağılımı. İçinde: Klinik bulaşıcı hastalıklar. Cilt 50, Sayı 9, Mayıs 2010, s. 1231-1237, doi: 10.1086 / 651598 , PMID 20233062 .
- ↑ a b c d e E. M. Poolman, AP Galvani: Kistik fibroz için selektif basıncın aday ajanlarının değerlendirilmesi. İçinde: Kraliyet Cemiyeti Dergisi. Cilt 4, sayı 12, Şubat 2007, sayfa 91-98 , doi: 10.1098 / rsif.2006.0154 , PMID 17015291 , PMC 2358959 (serbest tam metin).
- ↑ CM Anderson, J. Allan, PG Johansen: Kistik fibrozda heterozigot avantajın olası varlığı ve doğası üzerine yorumlar. İçinde: Bibliotheca pediatrica. Cilt 86, 1967, sayfa 381-387, PMID 6054652 .
- ^ MA Crawfurd: Pankreasın kistik fibrozunun heterosis kanıtlarını içeren genetik bir çalışma. Büyük Britanya Genetik Derneği'nin 168. Toplantısında, 1972, s. 126.
- ↑ JK Tobacman: Arilsülfataz B eksikliğinin kistik fibrozda rolü var mı? İçinde: Göğüs. Cilt 123, Sayı 6, Haziran 2003, sayfa 2130-2139, PMID 12796199 (inceleme).
- ^ AP Galvani, M. Slatkin: Veba ve çiçek hastalığının CCR5-Delta 32 HIV-direnç aleli için tarihsel seçici baskılar olarak değerlendirilmesi. İçinde: Ulusal Bilimler Akademisi Bildiriler Kitabı . Cilt 100, sayı 25, Aralık 2003, sayfa 15276-15279, doi: 10.1073 / pnas.2435085100 , PMID 14645720 , PMC 299980 (serbest tam metin).
- ↑ AL Hughes, R. Friedman, M. Murray: Mycobacterium tuberculosis'in iki tam genomunda eşanlamlı nükleotid ikamesinin genom çapında modeli. İçinde: Gelişen bulaşıcı hastalıklar. Cilt 8, sayı 11, Kasım 2002, sayfa 1342-1346, doi: 10.3201 / eid0811.020064 , PMID 12453367 , PMC 2738538 (serbest tam metin).
- ^ G. Modiano, BM Ciminelli, PF Pignatti: Kistik fibroz ve laktaz kalıcılığı: olası bir korelasyon. İçinde: Avrupa insan genetiği dergisi. Cilt 15, Sayı 3, Mart 2007, sayfa 255-259, doi: 10.1038 / sj.ejhg.5201749 , PMID 17180122 (inceleme).
- ↑ D. Saleheen, PM Frossard: deltaF508 mutasyonunun beşiği. İçinde: Ayub Tıp Koleji Dergisi, Abbottabad. Cilt 20, Sayı 4, 2008, s. 157-160, PMID 19999232 (inceleme).
- ↑ a b c Gerhard Dockter, Hermann Lindemann: giriş ve temel bilgiler. İçinde: Hermann Lindemann, Burckhardt Tümmler, Gerhard Dockter (ed.): Mukoviszidose - kistik fibroz. 4. baskı, Georg Thieme, 2004, ISBN 3-13-138604-5 , s. 1-2, Google kitap aramasında sınırlı önizleme
- ↑ a b Ulrich Grossekettler: Kistik fibrozda IL-18 ve IL-12 p40'ın artan serum konsantrasyonları Tez, Johann Wolfgang Goethe Üniversitesi Frankfurt am Main, 2005, s. 5 Google kitap aramasında kısıtlı önizleme
- ^ R. Busch: Kistik fibrozun tarihi üzerine. İçinde: Acta Universitatis Carolinae. Medica. Cilt 36, Sayılar 1-4, 1990, sayfa 13-15, PMID 2130674 (inceleme).
- ↑ a b James M. Littlewood: Kistik fibroz tarihi. İçinde: Margaret Hodson, Andrew Bush, Duncan Geddes: Kistik Fibrozis. 3. baskı, CRC Press, 2012, ISBN 978-1-4441-1369-3 , s. 3-19 ( Google kitap aramada sınırlı önizleme ).
- ↑ Ernst Ludwig Rochholz : Alemannic çocuk şarkısı ve İsviçre'den çocuk oyunları JJ Weber, Leipzig, 1857 Google kitap aramasında sınırlı önizleme
- ↑ M. Griese, D. Reinhardt: Patolojik ter testi sonuçlarının ayırıcı tanısı. İçinde: Dietrich Reinhardt, Manfred Götz, Richard Kraemer, Martin H. Schöni (ed.): Kistik fibroz. Springer-Verlag, 2013, ISBN 978-3-642-56796-4 , s. 212 ( Google kitap aramada sınırlı önizleme ).
- ↑ C. Falkman: Kistik fibroz - 52 çocuk ve aileleri üzerinde yapılan psikolojik bir çalışma. İçinde: Acta pediadia Scandinavica. Ek. Sayı 269, 1977, sayfa 1-93, PMID 274900 .
- ↑ JX Pfyffer: İsviçre Almancası sözlüğünden alıntı Cilt 7, 1848, s. 899. Bakınız: James L. Littlewood: Kistik fibrozun tarihi. İçinde: Margaret Hodson, Andrew Bush, Duncan Geddes: Kistik Fibrozis. 3. baskı, CRC Press, 2012, ISBN 978-1-4441-1369-3 , 486 s. ( Google kitap aramada sınırlı önizleme )
- ↑ G. Fanconi, E. Uehlinger, C. Knauer: Konjenital kistik pankreas fibrozu ve bronşektazide çölyak sendromu. İçinde: Wien Med Wochenschr. Cilt 86, 1936, s. 753-756.
- ↑ U. Stephan, M. Götz, K. Stephan, S. Bender: Kistik Fibrozis. İçinde: P. Frick, G.-A. von Harnack, GA Martini, A. Prader, HP Wolff (Ed.): Dahili Tıp ve Pediatride Gelişmeler. Cilt 44, Springer Berlin Heidelberg, 1980, ISBN 978-3-642-67559-1, s. 73-174 doi: 10.1007 / 978-3-642-67557-7_3
- ↑ a b K. Landsteiner: Kalınlaşmış mekonyuma bağlı bağırsak tıkanıklığı: pankreatit. İçinde: Genel patoloji ve patolojik anatomi için Centralblatt. Cilt 16, 1905, s. 903.
- ↑ a b Ralf Bröer: Katı, meraklı ve insancıl bir çocuk doktoru. İçinde: aerztezeitung.de. 11 Ekim 2004, erişim tarihi 12 Mart 2015 .
- ↑ Friedrich Katscher: Kistik fibrozlu insanlar için umut. İçinde: wienerzeitung.at. 26 Kasım 1999, erişim tarihi 12 Mart 2015 .
- ↑ DH Andersen: Pankreasın kistik fibrozu ve çölyak hastalığı ile ilişkisi. İçinde: Amerikan Çocuk Hastalıkları Dergisi. Cilt 56, 1938, s. 344-399.
- ↑ S. Zabransky, S. Isabel Zink: Kistik fibroz için bir araştırma testi olarak filtre kağıdı üzerinde kurutulmuş tam kan örneklerinde IRT tayini In: Siegfried Zabransky (Ed.): Konjenital endokrin ve metabolik bozukluklar için tarama. 2001, s. 269-296 doi: 10.1007 / 978-3-7091-6252-1_33 , ISBN 978-3-7091-7260-5
- ^ S. Farber: Pankreas fonksiyonu ve erken yaşamda hastalık. V. Erken yaşamda pankreas yetmezliği ile ilişkili patoloji değişiklikleri. İçinde: Kemer Yolu. Cilt 37, 1944, s. 238.
- ^ CU Lowe, CD May, SC Reed: Bebeklerde ve çocuklarda pankreas fibrozu; klinik ve kalıtsal özelliklerin istatistiksel bir çalışması. In: Amerikan çocuk hastalıkları dergisi. Cilt 78, Sayı 3, Eylül 1949, s. 349-374, doi: 10.1001 / archpedi.1949.02030050362008 , PMID 18138931 .
- ↑ RC Darling, PA di Sant'Agnese ve ark.: Pankreasın fibrokistik hastalığında terin elektrolit anormallikleri. İçinde: Amerikan tıp bilimleri dergisi. Cilt 225, Sayı 1, Ocak 1953, s. 67-70, PMID 13007698 .
- ^ LE Gibson, RE Cooke: İyontoforez ile pilokarpin kullanan pankreasın kistik fibrozunda terdeki elektrolit konsantrasyonu için bir test. İçinde: Pediatri. Cilt 23, Sayı 3, Mart 1959, s. 545-549, PMID 13633369 .
- ^ PM Quinton: Kistik fibrozda klorür geçirimsizliği. İçinde: Doğa. Cilt 301, Sayı 5899, Şubat 1983, sayfa 421-422, PMID 6823316 .
- ^ RG Knowlton, O. Cohen-Haguenauer ve diğerleri: Kistik fibroz ile bağlantılı bir polimorfik DNA markörü 7. kromozom üzerinde yer almaktadır. In: Nature. Cilt 318, Sayı 6044, 1985, sayfa 380-382, PMID 2999611 .
- ↑ JM Rommens, MC Iannuzzi ve diğerleri.: Kistik fibroz geninin tanımlanması: kromozom yürümesi ve zıplaması. İçinde: Bilim. Cilt 245, Sayı 4922, Eylül 1989, sayfa 1059-1065, PMID 2772657 .
- ^ WK Lemna, GL Feldman ve diğerleri: Heterozigot tespiti ve kistik fibrozun doğum öncesi teşhisi için mutasyon analizi. İçinde: New England Tıp Dergisi . Cilt 322, Sayı 5, Şubat 1990, sayfa 291-296, doi: 10.1056 / NEJM199002013220503 , PMID 2296270 . (Tam metin serbestçe erişilebilir)
- ↑ Nadir Hastalıklar
- ↑ Gastrit ve megaloblastik anemi ile birlikte kistik fibroz. İçinde: Orphanet (Nadir Hastalık Veritabanı).