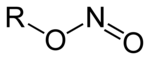nitritler
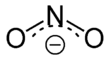
Nitriller olan tuzları (M + NO 2 - , E: tek değerli katyon ) ve esterleri : (R - - O, N = O, R bir organik artık madde) nitrik asit nitrik asit çözeltisi 2 . İzomerik nitro bileşikleri (R-NO 2 , organik artık madde direkt olarak azota bağlı olduğu) ayırt edilmesi olan nitröz asit esterlerinden .
Örnekler
|
|
||||||||||||||||||||||||||||
yapı
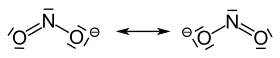
Nitrit iyonu , 115 ° bağ açısına sahip açılı bir yapıya sahiptir . Şekil iki mezomerik sınır yapısını göstermektedir :
oluşum
Nitrit iyonları kimyasal reaksiyon ile oluşturulmaktadır azot gazı ile oksijen , hava ve nem (bakınız asit yağmuru ) ve aynı zamanda su ve organları toprakta arıtma tesisleri atık su ile nitrit bakterileri ( Nitrosomonas ) tarafından oksidasyonu ile ilgili amonyum iyonları tüketimi oksijen. Protein parçalanması sürecinde amonyağın nitrata tam oksidasyonunda ( nitrifikasyon ) ara üründürler . Ayrıca nitrat iyonlarından ( nitrat redüktaz ) bakteriyel indirgeme yoluyla anaerobik koşullar altında ortaya çıkarlar .
Sudaki yüksek nitrit içeriği, suyun azot bileşikleri ile yoğun şekilde kirlendiğini gösterir.
Endüstride, metal yüzeylerin işlenmesi, galvanik işlemler ve nitrojen oksit içeren egzoz gazlarının temizlenmesi, bertaraf edilmeden önce arıtılması gereken toksik nitrit atıksu üretebilir.
kullanmak
Potasyum (E 249) ve sodyum nitrit (E 250) formundaki nitritler , nitrit kürleme tuzunda renk stabilizatörü olarak gıda katkı maddesi olarak kullanılabilir . Bununla birlikte, nitrit yasa dışı olarak da kullanılmaktadır; B. ton balığı boyamak için kullanılır .
Son derece tehlikeli botulizm bakterisi Clostridium botulinum'un gelişmesini engellediği için sosis üretiminde nitrit kullanımı zorunludur . İsviçre'de böyle bir zorunluluk yoktur. Parma jambonu veya chorizo gibi havada kurutulmuş et ürünleri nitrit gerektirmez.
Daha yüksek sıcaklıklarda, gıdanın kanserojen (kanserojen) olarak kabul edilen protein bileşenleri ile birlikte nitrozaminler oluşabilir . Bu nedenle tütsülenmiş et ürünleri kesinlikle ızgara yapılmamalıdır.
toksisite
Nitritler zehirlidir . Nitrit iyonu , hücresel solunumda ve hemoglobinde demir içeren enzimlerdeki demir atomları ile reaksiyona girer . Sonuncusu, nitrit tarafından methemoglobine oksitlenir (ayrıca bakınız methemoglobinemi ) , bu sayede oksijen taşıma yeteneği kaybolur. Nitritler ayrıca kanserojen nitrozaminlerin oluşumunda da rol oynar .
Nitrit da zehirlidir için balık üzerinde güçlü bir bağımlılık olmasına rağmen, ve 0.1 mg / l üzerinde konsantrasyonlarda suda yaşayan diğer hayvanları pH değeri su sadece nitröz asit, vücuda almak yoluyla solungaçları . LD 50 nitrous asit (akut toksisite) yaklaşık 0.01 mg / her tatlı su balık türleri için l. Nitrit iyonları , sudaki konsantrasyonları yaklaşık 15 mg / l'nin oldukça altında olduğunda aslında klorür iyonlarını emmeye yarayan aktif bir taşıma mekanizması yoluyla balığa başka bir yol bulur . Nitrit deniz suyunda çok daha az toksiktir. Aktif taşıma mekanizması, klorür iyonlarının alımı nedeniyle, bu aktif alım nitrit alımı ile rekabet halindedir. 20 g / l klorür konsantrasyonu ve 1 mg / l nitrit konsantrasyonu ile bir nitrit iyonu için 25.000 klorür iyonu vardır. Bunlar, herhangi bir nitritin yerini alır, böylece nitrit önemli ölçüde daha küçük ölçüde emilir.
Organik nitritler vücutta nitrojen monoksit donörleri olarak hareket eder ve böylece düz kasları gevşetmek ve vazodilatasyona neden olmak için ikinci bir haberci mekanizması kullanan etkisini gösterir . Gelen Aşırı dozda da tedavi kullanılmamış nitritler şiddetli düşmesine yol açabilir tansiyon , kalp-damar çöküşü kadar şok gelir. Gibi nitriller izobutil nitrit ve amil nitrat olan aphrodisiacs olarak teneffüs adı altında Poppers .
Nitrit içeren atık suların arıtılması
Nitritleri bir alıcı suya veya kanalizasyon sistemine deşarj edilmeden önce kanalizasyondan uzaklaştırmak için çeşitli yöntemler mümkündür. Ana prosedürler aşağıdaki gibidir:
- Oksidatif kimyasallarla atıksu arıtımı . Bu hipokloritler ve peroksitler uygundur. Uygulamada pH değeri önemlidir. Zayıf asidik koşullarda reaksiyon hızı yüksektir ve kantitatif olarak aşağıdaki denklemlere göre gerçekleştirilir:
veya
Bazik aralıkta ise reaksiyonlar çok yavaş ilerlerken, kuvvetli asidik aralıkta pH <2.0'da nitröz gazlar oluşur. İkinci reaksiyonun denklemi aşağıdaki gibidir:
Arıtma için hipoklorit kullanmanın dezavantajı, suyun klorür ve nitratlarla tuzlanmasıdır. Ayrıca, su HC içeriyorsa hidrokarbonların (HC) organik halojen bileşikleri ( AOX ) ortaya çıkabilir. Peroksitler kullanıldığında, metaller veya metal tuzları tarafından katalitik bozunma riski vardır. Bu, ekonomik olmayan peroksit tüketimine neden olabilir.
- Nitritleri uzaklaştırmanın başka bir yolu da onları sülfamik asit veya üre ile parçalamaktır . Nitritlerin azalmasına yol açan bozunma, aşağıdaki denkleme göre sülfonik asit için gerçekleşir:
ve buna göre üre için:
Sülfamik asit kullanırken sülfatların ve serbest asitlerin oluşumu dikkate alınmalıdır. İkincisi, arıtılmış atık sudaki tuz içeriğinin artması için nötralizasyon gerektirir. Ayrıca, uygun olmayan koşullar altında nitrojen oksitler oluşturulabilir. Azotlu gazların gaz çıkışı önlenirse, üre kullanıldığında bu dezavantajlar oluşmaz. Bu, bozunma kapalı bir reaktörde gerçekleştirilirse başarılabilir. Aynı zamanda amonyum (NH 4 + ) aşağıdaki denkleme göre de parçalanabilir:
Üre kullanımı ekolojik olarak faydalıdır, çünkü nihai ürün olarak sadece nitrojen ve karbondioksit ve su gazları üretilir. Atık sularda tuz birikmesi önlenir.
kanıt
Nitrit, bir renk reaksiyonu vasıtasıyla tespit edilebilir. Bu amaçla, sulu numune, 1858'den itibaren Johann Peter Grieß'in reaksiyonuna göre biraz Lunge reaktifi (asit, kısmen kararlı sülfanilik asit ve α-naftilamin çözeltisi ) ile karıştırılır . Oluşan azo boyası nedeniyle kırmızı-mor renklenme gösterir. nitrit.
Bu reaksiyon, nitrit z'nin kantitatif tayini için fotometrik ölçüm ile daha da geliştirilmiştir. B. suda kullanılır. DIN EN 26 777'de standartlaştırılmıştır (1993'e kadar: DIN 38 405 D10).
Ayrıca bakınız
İnternet linkleri
Bireysel kanıt
- ↑ Dietmar Kunath: Nitritler. İçinde: Claus Schaefer, Torsten Schröer (Hrsg.): Akvaryum biliminin geniş sözlüğü. Eugen Ulmer, Stuttgart 2004, ISBN 3-8001-7497-9 , s. 708.
- ^ Gerhard Gutekunst, Waldemar Mzyk. İçinde: WLB Su, Hava ve Toprak. 1-2, 1991, s.39.
- ↑ Basel-Stadt Kantonu Sağlık Bakanlığı: Ton balığı etinin yasa dışı boyanması. İçinde: gd.bs.ch . 28 Mayıs 2019. Erişim tarihi: 28 Mayıs 2019 .
- ↑ Dietmar Kunath: Nitritler. 2004.
- ↑ Armin Glaser: Danışman deniz suyu kimyası. 2008, Rüdiger Latka Verlag, ISBN 978-3-9810570-2-7 .
- ^ Gerhard Gutekunst, Waldemar Mzyk. İçinde: WLB Su, Hava ve Toprak. 1-2, 1991, s. 39-40.
- ^ Gerhard Gutekunst, Waldemar Mzyk. İçinde: WLB Su, Hava ve Toprak. 1-2, 1991, s. 40.