Marcus teorisi
Marcus teorisi (adını Rudolph Arthur Marcus ) alır yerini Eyring teorisi içinde redoks reaksiyonları bağ oluşumu veya bağ olmadan kırma . Her iki teori de aynı üstel formdaki oran denklemlerine yol açar. Reaksiyon sırasında reaktanlar arasındaki bağdaki değişiklikler Eyring teorisinde belirleyici olurken, çözücü ( dış küre ) bu redoks reaksiyonlarında (tek elektron değişim reaksiyonları) merkezi rolü oynar. Marcus teori gösterir, bu ve Gibbs hesaplanmasını sağlar aktivasyon serbest entalpisi gelen polarizasyon elektron transferi ve redoks reaksiyonun serbest entalpisi sırasında çözücü, boyut ve reaktanlar arasındaki mesafenin özellikleri.
Giriş
Kimyasal reaksiyonlar malzeme değişikliklerine neden olur. Örneğin B. molekül içindeki bir grubun veya kompleks içindeki bir ligandın ikamesine , molekülün bir kısmının veya bir ligandın bölünmesine veya bir yeniden düzenlemeye yol açar . Bununla birlikte, yalnızca reaktanların şarj durumunu değiştirmek de mümkündür ve bu redoks reaksiyonları, iyonlar ve kompleksler içeren inorganik kimyada özellikle basit görünmektedir. Geçiş metallerinin iyonları söz konusu olduğunda, bu tür reaksiyonlar genellikle renk değişimleri açısından gözlemlenebilir , ancak organik moleküller, herbisit paraquat (1,1'-dimetil-4,4) gibi elektronları kabul ettiklerinde veya saldıklarında da renk değiştirebilirler. '-bipiridinyum), elektronlar kabul edildiğinde maviye döner. Metilviologen alternatif adının geldiği yer burasıdır. Marcus, yapısal değişiklikler olmaksızın bir tür redoks reaksiyonu için teorisini geliştirdi. Orijinal makaleler matematiksel muhakeme için kullanılmalıdır.
Bir redoks reaksiyonunda, bir ortak elektron vericisi D, diğeri elektron alıcısı A olarak hareket eder . Böylece ortaklar tepki verebilir, birlikte yayılmaları gerekir. Prekürsör kompleksi olarak adlandırılan kompleksi oluştururlar, genellikle kinetik, kararsız, çözülmüş çarpışma kompleksi, elektron transferi yoluyla ardıl bir komplekse dönüşür ve bu da sırasıyla dağılır. Tek elektron transferi için bu, reaksiyon denklemini verir
(D ve A kendileri yük taşıyabilir). Burada, k 12 , k 21 ve k 30 olan difüzyon sabitleri , k 23 ve k 32 olan aktif kısmi reaksiyonların hızı sabitleri. Elektron transferi difüzyondan daha hızlıysa genel reaksiyon difüzyon kontrollü olabilir. Her şok bir tepkiye yol açar. Reaksiyon aktivasyon kontrollü ise, bağlantı dengesi kurulur, elektron transferi daha yavaş adımdır ve ardıl kompleksin ayrılması daha hızlı adımdır.
Redoks reaksiyonları genellikle polar çözücülerde gerçekleşir, verici ve alıcı merkezlerinde daha sonra bir solvasyon kabuğuna sahiptir ve öncü ve sukesör kompleksleri de çözülür. Solvasyon kabuğunun çok sıkı bir şekilde bağlanan iç molekülleri, komplekslerde ligandlar da iç küre olarak adlandırılır. Bu kürenin dahil olduğu redoks reaksiyonlarına "iç-küre" reaksiyonları denir. Dış küre, serbest çözücü moleküllerden oluşur. "Dış küre" reaksiyonlarında, iç küre değişmez, hiçbir bağ kopmaz veya oluşmaz.
RA Marcus, redoks reaksiyonlarında serbest aktivasyon entalpisinin doğası ve boyutu, daha kesin olarak dış küre tipi tek elektron transfer reaksiyonları ile ilgilenmiş ve çözücünün merkezi rolünü kabul etmiştir. Başlangıçta iki makale yayınladı. Marcus'un çalışması daha sonra bunun çok ötesine geçmesine rağmen, sonuçlarından genellikle Marcus teorisi olarak bahsedilir.
Sorun
Dış küre redoks reaksiyonlarında hiçbir bağ yapılmaz veya kopmaz. Yalnızca bir elektron transferi (ET) vardır. Basit bir örnek Fe 2+ / Fe 3+ redoks reaksiyonudur. Örn. İçeren sulu bir çözelti içinde gerçekleşen kendi kendine değişim reaksiyonunda B. hem FeSO 4 hem de Fe 2 (SO 4 ) 3'ü içerir , her iki yönde aynı ölçülebilir brüt hızda yer alır, termodinamik serbest standart reaksiyon entalpisi (ΔG 0 ) sıfırdır.
Hızın sıcaklığa bağlılığından z. B. gibi bir reaksiyon S , N 2 , bir alkil halid sabunlaşma ikame reaksiyonunda, bir aktivasyon enerjisi genellikle belirlenir ve bu da bir enerji olarak karakterize edilir , geçiş halinin reaksiyon şemasında. Arrhenius ve Eyring'e göre ikincisi, başlangıç malzemelerinden ürünlere enerji açısından en uygun yolu tanımlayan apsis olarak reaksiyon koordinatı ile bir enerji diyagramı olarak çizilir. Reaksiyon koordinatlarının noktaları , bağların oluşumu ve / veya kopması sırasında reaktanlar arasındaki ve içindeki mesafe ve açı kombinasyonlarının bir dizisidir . Enerji diyagramındaki maksimum - geçiş durumu - atom çekirdeğinin çok özel bir konfigürasyonu ile karakterize edilir. Eyring'in geçiş durumu teorisinde, çekirdek koordinatlarda çok özel bir değişiklik de maksimumun geçilmesinden sorumludur, bu nedenle bu koordinat yönündeki salınım Eyring'in teorisinde bir çeviri olarak ele alınır.
Bu reaksiyon yolu, dış küre redoks reaksiyonlarında var olamaz. Yine de bir aktivasyon enerjisi gözlenir. Aktivasyon kontrollü reaksiyon için hız sabiti Eyring denklemi ile aynı forma sahiptir.
In esas olarak geçiş olasılığıdır ve geçiş durumunun oluşumu için serbest entalpidir.
Marcus'tan model
Elektronlar değiştirildiğinde, yük dağılımı değişir ve bunun çözücü ortamı üzerinde büyük etkileri vardır, çünkü çözücü molekülleri kendilerini yükler alanında hizalar (buna yönelim polarizasyonu denir ) ve çözücü moleküllerdeki atomlar ve elektronlar da biraz kaymış (atom veya elektron polarizasyonu ). Redoks reaksiyonlarında, bu solvent polarizasyonu aktivasyon enerjisinin boyutu ve dolayısıyla reaksiyon hızı üzerinde belirleyici bir etkiye sahiptir.
İkame, eliminasyon ve izomerizasyon reaksiyonları, dış küre redoks reaksiyonlarından sadece yapısal değişikliklerde değil, aynı zamanda reaktanlardaki tüm bireysel nükleer ve yük kaymalarının ( yük transferi , yük transferi, CT) üzerinde uyumlu bir şekilde gerçekleşmesi bakımından farklılık gösterir . En fazla enerji verimli reaksiyon yolu, çekirdek konfigürasyonları bu nedenle her zaman birbirine göre "denge" içindedir - bu nedenle maksimum enerji, potansiyel enerji yüzeyinin yalnızca bir boyutunda meydana gelir , diğerlerinin hepsinde hala bir minimum vardır. Bir örnek, S , N , bir alkil ki burada halid, hidroliz 2 ikame bir halid iyonu yer değiştirir OH arka tarafı saldırısı - beş bağlı karbon atomu ile birlikte bir geçiş durum üzerinden iyon olan ve devam eder. Reaktan sistemleri, reaksiyon sırasında o kadar güçlü bir şekilde bağlanır ki, tek tip bir yapı ve nihayetinde aktive edilmiş bir kompleksi temsil ederler. Çözücü, göz ardı edilemez, ancak kıyaslandığında çok az etkiye sahiptir.
Dış küre redoks reaksiyonlarında, reaktanlardaki nükleer kaymalar çok küçükken çözücü belirleyici faktördür. Verici ve alıcı arasındaki bağlantı zayıftır; her ikisi de reaksiyon boyunca kimliklerini korur. Bu nedenle, temel bir parçacık olarak elektron, yalnızca bir bütün olarak "sıçrayabilir" ( elektron transferi ET). Elektron sıçraması, eğer gerçekleşirse, çözücü moleküllerin hareket edebileceğinden çok daha hızlıdır ( Born-Oppenheimer yaklaşımı ). Sonuç şudur: elektronun sıçrayabilmesi için, iki reaktantın ve tüm çözücü moleküllerinin çekirdek pozisyonları hızlı elektron sıçramasından önce ve sonra aynı olmalıdır ( Franck-Condon prensibi ); ve enerji elektron sıçraması sırasında da değişmemelidir.
Çözücü düzenlemesi şarj koşullarına bağlıdır. Elektron sıçramasından önce ve sonra aynı olsaydı, kendi kendine değişim reaksiyonu için herhangi bir doğru düzenleme, tek başına simetri nedeniyle, yarım temel yük aktarıldığında oluşturulan bir çözücü konfigürasyonu ile gerçekleştirilebilirdi. Aynı zamanda, bu çözücü ortamda, öncül ve ardıl kompleks aynı enerjiye sahip olacaktır. Bu çözücü düzenlemesinde, elektron sıçraması için koşullar karşılanacaktır.
Bununla birlikte, elektron, temel bir parçacık olarak bölünemediği için, kaynakta veya hedef atom veya molekülde yer alması gerekir. Bu nedenle, "geçiş durumunda", çözücü konfigürasyonu (yarım yükün transferine karşılık gelir) ve yük dağılımı (ortaklardan birindeki yük) "denge" halinde değildir. Bununla birlikte, bu geçiş durumuna elektron sıçramasından önce ulaşılması gerekir ve bu, çözücüdeki termal dalgalanmalar yoluyla olabilir. Oluşmasından doğru çözücü, konfigürasyon ve elektron atlama bir ölçüde ayrılmış ve artık senkronize olmasını bulunmaktadır. Aslında birbirleriyle hiçbir alakaları yok. Geçiş durumunun enerjisi bu nedenle büyük ölçüde çözücünün polarizasyon enerjisidir.
Marcus Teorisi
Makroskopik sistem: iki iletken küre

Bu değerlendirmelere dayanarak, Rudolph A. Marcus klasik bir teori geliştirdi . Amacınız, söz konusu denge dışı durumun polarizasyon enerjisini hesaplamaktır. Termodinamikten biliyoruz ki, böyle bir enerjinin, oraya ulaşmak için tersine çevrilebilir bir yol bulunursa hesaplanabileceğini biliyoruz. Marcus bunu başardı.
Teorinin dayandığı modeli dört unsur oluşturuyor: (1) Marcus başlangıçta, yükün (çok sayıda temel yük) herhangi bir oranda iki cisim arasında aktarılabildiği klasik, tamamen elektrostatik bir model kullanıyor. (2) Marcus ayıran hızlı elektron polarizasyon p e ait bir çözücü ve yavaş atom ve yönlenme polarizasyon P u on güçler tarafından farklı olan ayarlanır hangi zaman sabitleri temelinde. (3) Marcus, iç küreyi (reaktan + katı olarak solvatlanmış çözücü kabuk, kompleksler için: + ligandlar) ve dış küreyi (dışarıdaki serbest çözücü) ayırır. (4) Marcus yalnızca, geniş kapsamlı elektrostatik kuvvetler nedeniyle genellikle iç tarafın katkısından çok daha büyük olan, bir çözücü içindeki "geçiş durumunun" denge dışı polarizasyonunun dış küre enerjisini hesaplar (bkz. Debye-Hückel elektrokimya teorisi ) Küre. Bunu yapmak için, iki tersinir şarj veya yeniden yükleme adımıyla bir rota seçer.
Araç, çözümlerde dielektrik polarizasyon teorisini sağlar . Marcus, genel olarak, belirli hacim ve yüzey yüklerine sahip herhangi bir şekle sahip 2 gövde arasındaki bir yük aktarımı için sorunu çözer. Kendi kendine değişim redoks reaksiyonu durumunda, redoks çifti (örneğin Fe (H 2 O) 6 3+ / Fe (H 2 O) 6 2+ ), belirli bir şarj durumundaki iki makroskopik, iletken küre ile değiştirilir. aralarında belirli bir mesafe, belirli bir miktar yükün tersine çevrilmesi gerekir.
İlk adımda, her iki topun da değiş tokuş edilecek yükün yarısını taşıdığı durum için enerji W I hesaplanır. Bu durum, bu değişim yükünün verici küreden boşluğa ve oradan da alıcı küreye aktarılmasıyla yük miktarının yarısının bir küreden diğerine geri dönüşümlü olarak aktarılmasıyla sağlanabilir. Bu şekilde boşaltılan küreler toplam çözücü polarizasyon P olan bir çözücü içinde, belirli bir elektrik alanı oluşturmak E + P u olan kurdu. Öte yandan, çözücünün polarizasyonu artık yükü ve polarizasyonu etkileyen bir alan bileşeni oluşturur.
İkinci aşamada, değiştirilen yükün yarısının tersine çevrilebilir (geri) aktarımının enerjisi W II , yine vakum yoluyla, birinci küreye belirlenir. Bununla birlikte , atomik ve yönelim polarizasyonu P u kaydedilir , yeni yük dağılımı ve şimdi sabitlenen P u alanında sadece elektron polarizasyonu kurulabilir . Sistem daha sonra redoks reaksiyonunun başlangıç durumuna karşılık gelen bir elektron polarizasyonu ve aktive edilmiş komplekse karşılık gelen bir atomik ve yönelim polarizasyonu ile istenen durumdadır. Bu durumun enerjisi W I + W II termodinamik olarak serbest bir entalpi G'dir.
Elbette bu klasik modelde, ücret aktarımı yalnızca ücret miktarının yarısı için değil, aynı zamanda diğer bölümler için de mümkün. Dolayısıyla, enerjiyi iki küre üzerindeki yük dağılımının ve dolayısıyla çözücü polarizasyonunun bir fonksiyonu olarak hissedebilirsiniz. Bu zarif yolla Marcus, tüm çözücü moleküllerinin koordinatlarını, yük aktarımı Δe ile belirlenen tek bir polarizasyon koordinatı Δp'de birleştirdi ve böylece enerji temsilinin yalnızca iki boyutta basitleştirilmesini sağladı: G = f (Δe) . Bir çözücüdeki iki iletken kürenin sonucu, Marcus formülüdür
burada r 1 ve r 2 iki kürenin yarıçaplarıdır, R aralarındaki mesafedir ve ε s ve ε op çözücünün statik ve yüksek frekanslı (optik) dielektrik sabitleridir . Δe aktarılan yük miktarıdır, G - Δe grafiği bir paraboldür (Şekil 1). Marcus teorisinde, tüm bir yükün transferine karşılık gelen enerji (Δe = 1), (dış küre) yeniden düzenleme enerjisi λ o , yani; H. Polarizasyonun tüm aktarılan yüke karşılık geldiği, ancak yük dağılımının transferden önceki duruma karşılık geldiği iki-küre sistemin enerjisi. Sistem, değişim yönüne göre simetriktir.
Mikroskobik sistem: redoks çifti
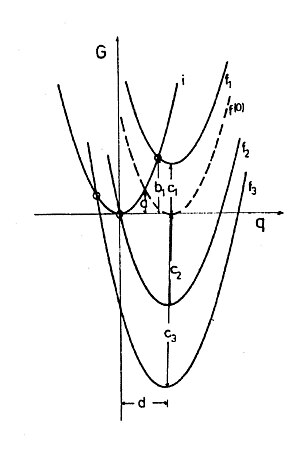
Klasik iki bilyeli sistemin boyutu kendi kendine değişim reaksiyonu noktasına küçültüldüğünde, yükün artık keyfi kısımlar halinde aktarılamayacağı, yalnızca temel bir yük olarak aktarılamayacağı kuantum tarafından belirlenmiş redoks çiftine ulaşılır. Solvent polarizasyonu hala klasik olarak tedavi edilebilir, yani. H. çok sayıda çözücü molekül tarafından ortaklaşa belirlendiği için nicelleştirilmez. Bu nedenle , Marcus formülüne göre bir kısmi temel yükün varsayımsal bir aktarımı ve yeniden aktarımı için yeniden organizasyon enerjisi hesaplanabilir . Yeniden düzenleme enerjisi aynı zamanda kimyasal redoks sistemleri için bir paraboldür (Şekil 2.) ve serbest enerjiye veya serbest entalpiye karşılık gelir. Sistemin bir elektron yükünün (Δe = 0.5) varsayımsal transferi ile sahip olacağı enerji, kendi kendine değişim reaksiyonunun aktivasyon entalpisidir ΔG (0) ‡ = λ o / 4 (bkz. Şekil 1 ve Şekil 2). , Parabolas i ve f veya f (0) 'ın kesişimi).
Şimdiye kadar her şey saf fizikti, şimdi biraz kimya eklendi. Kendi kendine değişim reaksiyonu, redoks reaksiyonları arasında bir uzmanlık alanıdır. Redoks reaksiyonlarının çoğu farklı ortaklar arasında gerçekleşir, örn. B.
ve böylece pozitif (endergonik) veya negatif (ekzergonik) serbest entalpisi ΔG 0 gösterir .
Marcus hesaplamaları yalnızca çözücüdeki (dış küre) elektrostatik koşullara atıfta bulunduğundan, ΔG 0 ve λ o birbirinden bağımsızdır ve basitçe katkı maddesi, yani H. Farklı ΔG 0 olan sistemlerin Marcus parabolleri yalnızca G'ye karşı Δe diyagramında yukarı veya aşağı kaydırılır (Şekil 2). ΔG 0 varyasyonu deneysel olarak, örneğin bir donöre farklı alıcılar sunarak elde edilebilir.
İ (y = x 2 ), f (0) (y = (x - d) 2 ) ve f 1 - f 3 (y = (x - d) 2 + c denklemi) parabolleri ile basit bir hesaplama ücretsiz aktivasyon entalpisi için
Parabollerin kesişme noktasının polarizasyon enerjisini temsil ettiğini , reaktanların tüm çekirdeklerinin belirli bir konfigürasyonunun enerjisini değil, örn. B. bahsedilen ikame reaksiyonunda. Her reaktan çiftindeki geçiş durumunun geometrisi bu durumda ideal olarak aynı olsa da, birçok farklı polarizasyon ortamına sahip redoks çiftleri enerjik koşulu karşılayabilir. Bu nedenle tek başına, serbest aktivasyon enerjisinin termodinamik bir miktar olarak kullanılması uygundur.
Marcus'un formülü (2), reaksiyonun serbest entalpisi ile serbest aktivasyon entalpisi arasındaki ikinci dereceden bir ilişkiyi gösterir. Bu, kimyanın harika deneysel materyalinden bir deneyimdir: reaksiyonlar genellikle daha hızlı ilerler, daha negatif negativeG 0 olur. Çoğu durumda doğrusal bir serbest enerji ilişkisi (LFE) bile bulunur. Marcus formülüne göre de reaksiyon hızları, reaksiyonlar daha ekzergonik hale geldiğinde artar, ancak sadece ΔG 0 pozitif veya orta derecede negatif değer aralığında olduğu sürece . Tepkimenin serbest entalpi çok olumsuz ise, formül (3) 'e göre çözelti içinde redoks reaksiyonları için aktivasyon serbest entalpi AG, yani zaman, daha büyük olması gerektiği şaşırtıcıdır 0 olduğu negatif ve λ daha kesinlikle büyük o . Serbest reaksiyon entalpisinin bu alanı "ters çevrilmiş Marcus" alanı olarak adlandırılır . Şekil 2'de, ΔG 0'da daha fazla azalma ile i ve f parabollerinin kesişme noktasının sol üste hareket ettiğini görebilirsiniz, bu da serbest aktivasyon entalpisinde bir artış ve hızda bir azalma anlamına gelir. Bu nedenle k ve ΔG 0 cinsinden gösterim bir maksimum eğri olmalıdır.
Maksimum reaksiyon hızı ΔG ‡ = 0'da beklenir. Burada, Δe = 0 veya q = 0 (Şekil 2). Bu, elektronun, reaktanların denge çözücü polarizasyonunda sıçrayabileceği anlamına gelir; bu, tabii ki, termal olarak uyarılmış olandan çok daha büyük olasılıkla gerçekleştirilebilir: bu durumda reaksiyon, engelsizdir. Ters alanında, hiç kutuplaşma karşılık zor düşünmek donör, tepkinenlere düzenlenen sanal bir yük dağılımının fikri olurdu alınmış ücret ve alıcı olurdu vazgeçmiş ücret . Gerçekte, tabii ki bu gerçekleşmez, çünkü bu polarizasyonu yaratan gerçek bir yük transferi değil, çözücüdeki termal dalgalanmalardır. Tersine çevrilmiş alan için gerekli olan polarizasyon, termal dalgalanma nedeniyle belirli bir olasılıkla kendini ayarlayabilir ve aynı türden herhangi bir enerji olabilir. Bir anlamda elektron, sıçrayana kadar doğru polarizasyonu bekler.
Deneysel sonuçlar
Marcus teorisini 1956'da yayınladı. Tersine çevrilmiş bölge yıllarca arandı, ancak deneyler, azalan ΔG 0 ile reaksiyon serileri için difüzyon kontrollü değere kadar yalnızca k artışı gösterdi , yani. H. hangi değere her bir reaksiyona reaktanlar potansiyel çarpışması ve bu sınır değeri daha kuvvetli, negatif AG bölgesinde muhafaza edildi 0 değerleri ( Rehm-Weller davranışı ). Miller, Calcaterra ve Closs'un ters çevrilmiş bölgesinin açıkça gösterilebilmesi yaklaşık 30 yıl sürdü, yani donör ve alıcının sabit bir köprü ile sabit bir mesafede tutulduğu bir moleküldeki moleküler içi elektron transferi durumunda. (Şekil 3).
Örneğin , serbestçe dağılan reaksiyon ortaklarıyla elektron sıçramasının λ o = - ΔG 0 , yani ΔG # = 0 olan R mesafesinde gerçekleştiği varsayılabilir . Λ o R'ye bağlı olduğu için, λ o daha büyük bir R ile daha büyük hale gelir, parabolün açıklığı daha küçüktür ve Şekil 2'deki parabolleri daraltmak her zaman biçimsel olarak mümkündür, böylece f-parabol, i'nin tepe noktasından geçer. -parabola gider. Bu, ΔG ‡ = 0 olduğu ve hız sabiti k'nin, çok negatif reaksiyon entalpisi ΔG 0 olan tüm redoks reaksiyonları için difüzyonla ilgili limitin maksimum değerini varsaydığı anlamına gelir . Bununla birlikte, çok hızlı elektron transferleri durumunda hızdaki bir düşüşün, deneysel olarak elde edilebilecek çok negatif ΔG 0 değerlerinin ötesinde olduğu görüşü de vardır . Heyecanlı elektronik devletlerin katılımı da tartışıldı.
R. A. Marcus ve arkadaşları, teorinin ilk yayınlanmasını takip eden yıllarda teorinin çeşitli yönlerini geliştirdiler. İ.a var. istatistiksel değerlendirmeler ve kuantum etkileri hesaba katılır ve kemilüminesans sistemlerine ve elektrot reaksiyonlarına genişletilir . R. A. Marcus, 1992'de çalışmaları için Nobel Kimya Ödülü'nü aldı ve Nobel Dersi, çalışmalarına kapsamlı bir genel bakış sunuyor.
Destekleyici belgeler ve yorumlar
- ↑ a b c d KİMYADA ELEKTRON TRANSFER REAKSİYONLARI: TEORİ VE DENEY. (PDF; 1.0 MB) İçinde: Nobel Vakfı. Erişim tarihi: April 2, 2007 . veya bununla ilgili "Die Zeit" makalesinde: burada
- ^ A b R.A. Marcus: Elektron Transferini İçeren Oksidasyon-İndirgeme Reaksiyonları Teorisi Üzerine. I. In: The Journal of Chemical Physics . Cilt 24, No. 5, 1956, s. 966-978, doi : 10.1063 / 1.1742723 .
- ^ A b R. A. Marcus: Elektrostatik Serbest Enerji ve Dengesiz Polarizasyona Sahip Durumların Diğer Özellikleri I. In: The Journal of Chemical Physics. Cilt 24, No. 5, 1956, s. 979-989, doi : 10.1063 / 1.1742724 .
- ^ Peter W. Atkins : Fiziksel kimya. 2., 1. baskının düzeltilmiş yeniden baskısı. Arno Höpfner tarafından çevrilmiş ve tamamlanmıştır. VCH Verlagsgesellschaft, Weinheim ve diğerleri 1990, ISBN 3-527-25913-9 , sayfa 763-770.
- ^ R. Stephen Berry , Stuart A. Rice , John Ross : Fiziksel Kimya. Wiley, New York NY 1980, ISBN 0-471-04829-1 , s. 1147 ff.
- ^ Willard F. Libby : Sulu Çözeltide Elektron Değişim Reaksiyonları Teorisi. In: Journal of Physical Chemistry. Cilt 56, No. 7, 1952, sayfa 863-868, doi : 10.1021 / j150499a010 .
- ↑ Marcus, hesaplamalarında reaktanların vakum durumuna enerji sıfır noktasını yerleştirir. Bu nedenle, denklemlerine birçoğu B izole reaktanların çözülme enerjilerine içeren iso ve ön-madde kompleksinin elektrostatik oluşumu enerjisi.
- ↑ Dış küre yeniden düzenleme enerjisinin ikinci dereceden bağımlılığı, reaktanlardaki veya çözücüdeki nicelenmiş titreşimlerin bir sonucu değildir, teori tamamen klasiktir.
- ↑ Ters reaksiyon belki anlamayı kolaylaştırabilir: Bunun için, bütün bir elektronun varsayımsal olarak yeniden iletilmesindeki polarizasyon, A / D ve A - ve D + polarizasyon enerjilerinin eşit olduğu bir polarizasyon oluşturmak için yeterli değildir . Bu duruma ancak birden fazla temel yükün varsayımsal aktarımı ile ulaşılır.
- ↑ Orijinal çalışmaya bakmanız tavsiye edilir, JACS Wikipedia'ya resimleri devretme izni vermez.
- ↑ Dieter Rehm, Albert Weller : Asetonitril içinde floresan söndürme sırasında elektron transferinin kinetiği ve mekanizması. In: Bunsen Fiziksel Kimya Derneği Raporları . Cilt 73, No. 8/9, 1969, s. 834-839, doi : 10.1002 / bbpc.19690730818 , bu davranışı deneysel formülle açıkladı .
- ^ John R. Miller, LT Calcaterra, Gerhard L. Closs: Radikal anyonlarda molekül içi uzun mesafeli elektron transferi. Serbest enerji ve çözücünün reaksiyon hızlarına etkisi. In: Journal of the American Chemical Society. Cilt 106, No. 10, 1984, s. 3047-3049, doi : 10.1021 / ja00322a058 .
- ↑ Bu, bir kompleksin boyutunun sistematik olarak değiştirildiği çalışmaların sonuçlarıyla desteklenmektedir. (örneğin: Hermann Rau, Rolfdieter Frank, Gerhard Greiner: Donör-Alıcı Ayrımı ve Serbest Entalpi Değişiminde Elektron Transferinin Hız Bağımlılığı. The Ru (bpy) 3 2+ / Viologen 2+ System. In: The Journal of Physical Chemistry , Cilt 90, No. 11, 1986, sayfa 2476-2481, doi : 10.1021 / j100402a042 ).
- ^ Paul Siders, RA Marcus: Elektron Transfer Reaksiyonlarında Kuantum Etkileri. In: Journal of the American Chemical Society. Cilt 103, No. 4, 1981, sayfa 741-747, doi : 10.1021 / ja00394a003 ; Paul Siders, RA Marcus: "Ters Bölgede" Elektron Transfer Reaksiyonları için Kuantum Etkileri. In: Journal of the American Chemical Society. Cilt 103, No. 4, 1981, sayfa 748-752, doi : 10.1021 / ja00394a004 .
- ^ RA Marcus: Kemilüminesan Elektron Transfer Reaksiyonları Teorisi Üzerine. In: The Journal of Chemical Physics. Cilt 43, No. 8, 1965, sayfa 2654-2657, doi : 10.1063 / 1.1697190 .
- ^ RA Marcus: Elektron Transfer Reaksiyonları Teorisi Üzerine. VI. Homojen ve Elektrot Reaksiyonları için Birleştirilmiş İşlem. In: The Journal of Chemical Physics. Cilt 43, No. 2, 1965, sayfa 679-701, doi : 10.1063 / 1.1696792 .

![{\ mathrm {D + A \ {\ overset {{\ xrightarrow {k _ {{12}}}}} {{\ xleftarrow [{k _ {{21}}}] {}}}} \ [D { \ dotsm} A] \ {\ overset {{\ xrightarrow {k _ {{23}}}}} {{\ xleftarrow [{k _ {{32}}}] {}}}} \ [D ^ {+ } {\ dotsm} A ^ {-}] {\ xrightarrow {k _ {{30}}}} \ D ^ {+} + A ^ {-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/70e46f7dc59273ea085934cbfe0f52cbc39e29f1)




![{\ displaystyle \ mathrm {[Fe ^ {II} (CN) _ {6}] ^ {4-}} + \ mathrm {[Ir ^ {IV} Cl_ {6}] ^ {2-}} \ rightleftharpoons \ mathrm {[Fe ^ {III} CN_ {6}] ^ {3-}} + \ mathrm {[Ir ^ {III} Cl_ {6}] ^ {3-}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6d92a1d00db602e351dd6777cde3c1e713f35c06)


