Floresan mikroskobu

Floresan mikroskobu , özel bir ışık mikroskobu şeklidir . Floresansın fiziksel etkisine dayanmaktadır . Floresan maddeler belirli dalga boylarındaki ışıkla uyarılırsa, diğer, daha uzun dalga boylarının ışığını yayarlar ( Stokes kayması ).
Floresan mikroskobu ile incelenen nesnenin oluşturulan, büyütülmüş görüntüsü yalnızca yayılan (yayılan) ışıkla oluşturulur. Renk filtreleri uyarıcı ışığın görüntüye ulaşmasını engeller. Floresan mikroskobik görüntüler, mikroskobik örneğin tamamı eşit şekilde floresan değilse, ancak yalnızca bazı yapılar aydınlatılmışsa bilgilendiricidir. Bu yapılar, karanlık bir arka plana karşı ışık sinyalleri üretir.
Preparattaki her floresan molekülü yeni bir ışık kaynağı olarak görülebilir. Bu moleküllerin yaydığı floresanın yoğunluğu tespit limitinin üzerinde ise, mikroskobun çözünürlük limitinden çok daha küçük yapılar da floresan mikroskobu ile tespit edilebilir . Çözünürlük sınırı, klasik floresan mikroskobu ile aşılmaz, çünkü algılama küçük bir mesafede mümkündür, ancak sinyale bir veya daha fazla yapıdan kaynaklanıp kaynaklanmadığına dair bir açıklama yoktur. Bu açıdan karanlık alan mikroskobuna benzer .
Klasik olana ek olarak, floresan mikroskobunun çok sayıda geliştirilmiş özel formları vardır. Bunlar, örneğin, eş odaklı lazer tarama mikroskobu ve çok fotonlu floresan mikroskobu içerir . 1990'lardan itibaren, önemli ölçüde iyileştirilmiş bir çözünürlüğü gerçekten mümkün kılan çeşitli yöntemler geliştirildi. Bu sözde ultra çözünürlük veya süper çözünürlük yöntemleri aynı zamanda floresan mikroskobik tiptedir.
Temel bilgiler
floresan


Floresan bir molekül, bir fotonu emerek düşük enerjili temel durumdan (S 0 ) daha enerjik, uyarılmış bir duruma (S 1 ) dönüşebilen bir elektrona sahiptir . Hem S 0 hem de S 1 , elektronun salınım enerjisi (ayrıca: titreşim enerjisi) içeriği bakımından farklılık gösteren birkaç alt duruma sahiptir. S içerisinde ilk salınım durumuna arasındaki enerji farkı 0 ve salınım durumuna S ulaştığı 1 absorbe fotonun enerji içeriğine karşılık gelir tam.
Elektron temel duruma geri dönerse, bir foton yayılır. Bu ışık yayımı, absorpsiyondan birkaç nanosaniye sonra gerçekleşir - bu flüoresanstır. Ortaya çıkması için, S 0 ve S 1 arasında enerji içeriğinde açık bir fark olmalı ve aralarında başka enerji seviyeleri olmamalıdır, çünkü uyarılmış elektronlar aksi takdirde ışınımsal olmayan süreçler yoluyla temel duruma geri dönerler.
Temel durum hem S yana 0 ve uyarılmış durum S 1 sahip birkaç alt devletleri, benzer enerji içeriği ile sadece tam olarak belirli enerji içeriği absorbe veya yayılan edilebilir olan fotonları, aynı zamanda fotonları. Bir fotonun enerji içeriği dalga boyuyla ters orantılı olduğundan , bu, bir flüoresan maddenin birkaç benzer dalga boyu tarafından uyarıldığı anlamına gelir: Buna uyarım spektrumu denir . Aynı zamanda bazı benzer dalga boyları olan emisyon spektrumunu da yayar .
Floresans, uyarılmış en düşük enerji seviyesinden yayılır ( Kasha kuralı ). Elektron, uyarma fotonun absorpsiyonu yoluyla daha yüksek bir uyarılmış duruma yükseltilirse, ilk olarak, bir foton yayılmadan önce yayılmayan enerji yayımı yoluyla en düşük uyarılmış enerji seviyesine ulaşır. Bunun floresan mikroskobu için birkaç önemli sonucu vardır:
|
Floresan olan maddelere florofor denir. Preparatları boyamak için kullanılan floroforlar, floresan boyalar veya florokromlar olarak adlandırılır.
Otofloresans ve florokromlar

Bir numune kendi kendine floresan yaydığında bu, otofloresans, otofloresans veya birincil flüoresans olarak bilinir. Birçok bitki örneği için farklı bölgelerinde çok güçlü otofloresansı sahip tohum bitkileri içinde ahşap onların parçalarının sapı . Klorofil içinde kloroplastların yeşil bitki hücrelerinde kırmızı kuvvetle floresan olduğunu. Buna karşılık, hayvan hücreleri yalnızca zayıf bir şekilde floresan ışık yayar, ancak yine de belirli koşullar altında floresan işaretleri maskelemek için yeterince güçlüdür. Burada ana kaynaklarıdır flavinler bulunur, mitokondri ve bulunurlar, lipofusin içinde lizozomlar . Koenzim NADPH ayrıca hipootoflöresansta gösterir.
Florokromlarla bir preparatta yapay olarak üretilen bir floresan, ikincil bir floresandır. Buna yol açan işleme floresan etiketleme denir . İyi florokromlar birkaç özelliği birleştirir: (1) Yüksek bir foton soğurma olasılıkları vardır, yani yüksek bir soğurma katsayısına sahiptirler . (2) Soğurulan fotonların çoğu aslında bir floresan foton emisyonuna yol açar (yüksek kuantum verimliliği ). Her ikisi birlikte yüksek düzeyde parlaklığa yol açar. (3) Florokromlar, çok az ağartma sergilemelidir, bu da yok edilmeden sıklıkla uyarılabilecekleri anlamına gelir. (4) Ek olarak, florokromlar, farklı yapıları renklendirmek için aynı anda farklı flüoresan renkleriyle mümkün olduğunca çok sayıda florokromun kullanılabilmesi için mümkün olduğunca dar bir ışık spektrumu aralığında flüoresans yapmalıdır .
Renk kanalları
İki florokromun uyarılma ve emisyon spektrumları güçlü bir şekilde örtüşüyorsa, birbirlerinden ayırt edilemezler. Örneğin, floresan , yeşil floresan protein , spektrum yeşili ve ticari olarak temin edilebilen diğer bazı boyalar çok benzer spektrumlara sahiptir, bu nedenle floresan renklerine göre ayırt edilemezler. Farklı yapıları renklendirmek için farklı floresan boyalar yan yana kullanılacaksa, bu boyaların farklı spektrumlara sahip olması gerekir. Tipik olarak, UV ışığı mavi floresan florokromları, mavi ışık yeşil florokromları ve yeşil ışık kırmızı florokromları uyarır. Bu üç renk kanalı bu nedenle aynı örnekteki farklı yapıları temsil etmek için kullanılabilir.
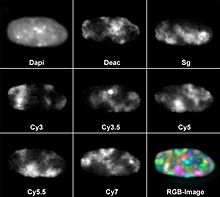
Ancak bu, aynı anda tespit edilebilen renk sayısını tüketmez. Paralel olarak halihazırda sekiz farklı florokrom kullanılmıştır. Bu amaçla, DAPI kullanıldı bir mavi floresan karşıt-leke olarak DNA gibi diğer yedi boyalar birleştirildi için gen probları için floresan in situ hibridizasyon : dietilaminokumarin (Deacon), Spectrum Yeşili ve siyanin Cy3, Cy3.5, Cy5 boyalar , Cy5 .5 ve Cy7. Çoğu floresan mikroskobu üç ila beş renk kanalına sahiptir.
Floresan mikroskopların yapısı
"Normal" ışık mikroskobu, iletilen ışık parlak alan mikroskobu ile görüntü, numunenin içinden parlayan ışık tarafından oluşturulur. Floresan mikroskobu ile durum böyle değildir. Burada görüntü, yalnızca numunede oluşturulan floresan ışık tarafından oluşturulur. Numunenin ışınladığı uyarma ışığı ise özel filtrelerle görüntü oluşturmanın dışında tutulur. Floresan ışık normal koşullar altında tüm uzamsal yönlerde eşit olarak yayıldığından, uyarma ışığının yukarıdan, aşağıdan veya yandan gelip gelmediği önemli değildir. Aslında, üç varyantın tümü uygulandı.
Floresan mikroskopisinin başlangıcında, 20. yüzyılın ilk yarısında, iletilen ışık floresan mikroskopları yapıldı. Bugün sadece tarihsel açıdan ilgi çekiyorlar ( aşağıdaki tarih bölümüne bakın). Dikroik aynaların (ayrıca: dikroik ışın ayırıcılar) mevcudiyeti, 1970'lerden itibaren uyarma ışığının objektif aracılığıyla numuneye yayıldığı olay-ışık flüoresan mikroskoplarının yapılmasını mümkün kılmıştır . Bunlara ayrıca Yunanca “açık” anlamına gelen epifloresan mikroskoplar da denir . Bu tür bir bina, 20. yüzyılın sonundan beri neredeyse tamamen kullanılmaktadır. Yan aydınlatma, özel bir floresan mikroskobu olan ışık diski mikroskobu ile kullanılır (aşağıya bakın).
Epifloresan mikroskobu: tipik floresan mikroskobu
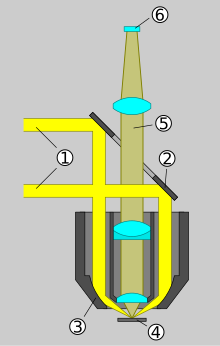
İletilen ışık parlak alan mikroskopları ile karşılaştırıldığında, epifloresans mikroskopları, floresan uyarma ışığı için ek bir gelen ışık aydınlatma eksenine sahiptir. Gözlemlenecek nesne mercek aracılığıyla aydınlatılır. Aşağıdaki numaralandırma şematik çizime atıfta bulunmaktadır.
- Uygun şekilde seçilmiş bir optik filtre , uyarma filtresi , kullanılan lambanın, üretilen ışığın yalnızca flüoresan boyanın uyarılması için gerekli dalga boylarını içeren kısmını iletmesine izin verir . Floresan boya parlar olan spektrum alanı gerekir edilemez geçmesine izin eksitasyon filtre.
- Bir ışın ayırıcı , uyarma ışığını hedefe yansıtır ve bunun üzerine numunede floresan ortaya çıkar. Amaç aynı zamanda yoğunlaştırıcının işlevini de üstlenir . Floresans, uyarma ışığından daha uzun bir dalga boyuna sahiptir.
- Floresan ışığın objektif tarafından toplanan kısmı ışın ayırıcıya ulaşır. Özel özellikleri nedeniyle, bu uzun dalgalı ışık, mercek veya detektöre iletilir (ve yansıtılmaz). Öte yandan numuneye yansıyan uyarma ışığı, büyük ölçüde lambaya geri yönlendirilir.
- Işın ayırıcılar mükemmel çalışmadığından, numunede yansıyan uyarma ışığının küçük bir kısmı yine de göz merceğine veya dedektöre ulaşır. Floresans yoğunluğu uyarıma göre çok zayıf olduğu için, kalan uyarma ışığını ortadan kaldırmak için bloke edici filtre veya emisyon filtresi olarak adlandırılan başka bir optik filtre gereklidir.
Bahsedilen üç filtre, günümüzün floresan mikroskoplarında genellikle ortak bir bloğun içine yerleştirilmiştir. Dik mikroskoplarda bu, objektifin üzerindeki optik eksende bulunur. Ters floresan mikroskoplar söz konusu olduğunda, buna göre objektifin altına yerleştirilir. Sonsuz optikli cihazlarda , objektif ve tüp lens arasındaki sonsuz boşluktadır.
Işık kaynakları
Numunede floresan oluşumu etkili bir işlem değildir: uyarma ışığının yalnızca bir kısmı floresan boyalar tarafından emilir. Yine de gözle görülebilen parlak sinyaller üretebilmek için çok yüksek ışık şiddetleri gereklidir.
Floresan mikroskopları tipik olarak cıva buharlı lambalar , metal halide lambalar , ksenon gaz deşarjlı lambalar veya 21. yüzyıldan beri LED lambalarla donatılmıştır. Çoğu ışık kaynağı , ultraviyole aralığının yanı sıra tüm görünür spektrum boyunca parlar . İncelenecek belirli florokrom için gerekli dalga boyları uygun bir filtre ile seçilir ve diğerleri bastırılır.
filtre
Geçmişte renkli camdan renk filtreleri kullanılırken günümüzde sıklıkla girişim filtreleri kullanılmaktadır. Bununla birlikte, girişim filtreleri önemli ölçüde daha pahalıdır, bu nedenle renkli cam hala kullanılmaktadır. Her iki tip de uyarma ve emisyon filtreleri için kullanılabilir. Dikroik ışın ayırıcı , sadece bir girişim filtresi olarak imal edilebilir.
Girişim filtreleri, üzerine birkaç ince malzeme katmanının uygulandığı bir cam bölmeden oluşur. Katmanlar arasında girişim meydana gelir , böylece belirli dalga boylarının geçmesine izin verilir, ancak diğerleri yansıtılır. Renkli camın aksine ışık absorbe edilmez. Uygun malzeme ve katman kalınlıkları seçilerek farklı dalga boyları için filtreler üretilebilir. Girişim filtresine farklı açılardan çarpan ışık, ilgili katmanlardaki farklı uzunluklardaki mesafeleri kapsar. Bu nedenle, filtre özellikleri ışığın geliş açısına bağlı olarak değişir. Bu nedenle, düzgün çalışması için mikroskopta amaçlanan açıda bir parazit filtresi takılmalıdır.
İşlevsellikleri açısından kısa geçiş, uzun geçiş ve bant geçiren filtreler arasında bir ayrım yapılır. Kısa geçiş filtreleri, ışığın belirli bir dalga boyuna kadar geçmesine izin verir . Bir KP480, 480 nm'ye kadar ışık iletir ve daha uzun dalga boylarına sahip ışığı engeller. Bunun aksine, uzun geçiş filtresi geçmesine ışık izin yoluyla gelen 520 nm'den daha uzun dalga boylarına sahip belirli bir dalga boyunda, bir LP520, ışık. Bant-geçişli filtreler, sadece spektrumun belli bir bölümü boyunca geçmesine izin verir. 525/50 atamalı bir bant geçiren filtre, merkezi 525 nm'de olan 50 nm'lik bir spektral pencerenin geçmesine izin verir, yani 500–550 nm'lik bir pencere. Bir filtrenin özellikleri genellikle yalnızca görünür aralıkla ilgilidir ve doğrudan bitişik spektral aralıklar. Bu nedenle, örneğin kızılötesinde görülebilir menzil için bir bant geçiren filtrenin tekrar geçirgen hale gelmesi mümkündür. Bu, iki fotonlu floresan uyarımı ile ilgili sorunlara yol açabilir (aşağıya bakın).
Girişim filtreleri ile daha karmaşık spektral özellikler de elde edilebilir. Örneğin, bir filtre birkaç spektral pencerenin geçmesine izin verebilir, ancak aradaki alanları bloke edebilir (çoklu bant geçişi). Birkaç spektral alanı yansıtan ve aradaki alanlara izin veren dikroik ışın ayırıcılar da uygundur (çoklu dikroik). Bu, aynı anda birkaç floresan kanalını görmeyi mümkün kılar. Bazı ışık kaynakları, farklı uyarma dalga boyları arasında çok hızlı bir şekilde geçiş yapabilir, örneğin bazı LED cihazları. Emisyon filtresi olarak bir multi-dikroik ve bir multi-bandpass filtresi kullanarak, hiçbir filtrenin hareket ettirilmesi gerekmediğinden, farklı floresans kanalları çok hızlı bir şekilde dönüşümlü olarak kullanılabilir.
Epifloresan mikroskoplarda, uyarma filtreleri, ışın ayırıcılar ve emisyon filtreleri genellikle filtre blokları halinde birleştirilir. Bir kanaldan diğerine, üç filtrenin tümü, üç ila dört renk için kombinasyonlar içeren bir slaydı hareket ettirerek veya her biri bir kanal için birkaç filtre küpünün monte edildiği bir çarkı döndürerek birlikte değiştirilir.
Floresanla çalışan bazı lazer tarama mikroskoplarında, uyarma filtrelerinin veya ışın ayırıcıların işlevi, acousto -optik modülatörlerle (AOM, ayrıca: acousto-optik ayarlanabilir filtre (AOTF) veya acousto -optik ışın ayırıcı (AOBS)) ile değiştirilir. Emisyon filtresi, bu cihazlarda tespitten önce yalnızca bir noktadan gelen flüoresan ışığın spektral olarak ayrılmasıyla değiştirilebilir ve daha sonra spektrumun yalnızca istenen kısımları tespit edilir. Böyle bir ayırma, bir prizma veya bir kırınım ızgarası ile elde edilir .
Dedektörler
Yaklaşık 620 nm dalga boyuna kadar insan gözü tarafından açıkça görülebilen aralıktaki parlak flüoresanslı preparatlar, doğrudan göz merceğinden görüntülenebilir. Belgeler için kameralar kullanılır. Daha önce fotoğraf filmi kullanılırken, 20. yüzyılın sonunda elektronik kameralara geçiş oldu . Genellikle siyah beyaz görüntüler alan CCD kameralar kullanılır . Kamerada renk filtresi olmadığından, tüm pikseller herhangi bir rengi kaydedebilir ve görüntü, renkli kameralarda olduğundan daha parlaktır. Kamera tarafından gerçekte hangi rengin kaydedileceği, yukarı akış emisyon filtresi tarafından belirlenir. Bir müstahzar içindeki farklı renkli floresan boyalar arka arkaya alınır ve bilgisayarda üst üste konulabilir. Renkleri daha iyi kontrastlamak için ilgili boyalara, isteğe bağlı olarak doğal renklerine veya diğerine, örneğin sonuncusuna herhangi bir renk atanabilir.
Floresan mikroskopisinde zorluk
Floresans solması

Floresan moleküller istedikleri sıklıkta uyarılamazlar çünkü uyarma ışığı ile yok edilebilirler. Foto ağartma olarak bilinen işlem , floresan preparatların fotostabilitesine bağlı olarak daha hızlı veya daha yavaş gerçekleşir. Tek bir flüoresan molekül için ağartma olasılığı az ya da çoktur.
Uyarılmış durumdaki bir molekül, yalnızca flüoresan yoluyla temel duruma (S 0 ) geri dönemez . İkinci bir olasılık, temel duruma geçiş sırasında enerjinin ısıya dönüştürüldüğü iç dönüşümdür . Üçüncüsü, boyanın fotokimyasal reaksiyonlarla yok edildiği solma . Bu reaksiyonlar elektronların spin durumlarıyla ilgilidir.
Bir florokrom elektronlar genellikle olan singlet haline molekülde elektronlar edildiği, Spin eşleştirilmiş. Bu nedenle temel durum, S 0 olarak da anılır , "normal" uyarılmış durum S 1 olarak adlandırılır (enerji diyagramlı şekle bakın). De tarif edilen , yukarıda , S 0 ve S 1 sahiptir , her biri enerji düzeyi açısından biraz farklı, çok sayıda alt-durumlarını gösterir. Ek olarak, enerji seviyesi S 1'den önemli ölçüde daha yüksek olan, daha enerjik, uyarılmış başka durumlar da vardır . Bunlar S olarak adlandırılır 2 , S 3, ve böyle devam eder. Bunların da birkaç alt devleti var. Yüksek enerjili bir foton, bir molekülü temel durumundan bu durumlardan birine hareket ettirebilir. Absorpsiyon spektrumu daha sonra ilgili enerji içeriğiyle dalga boylarında yerel bir maksimum gösterir (spektrumların resmine bakınız). Floresans spektrumu aynı kalır, çünkü floresan fotonu her zaman en düşük uyarılmış durumdan yayılır (ayrıca yukarıya bakın).
Tekli hallere ek olarak, üçlü durumlar da meydana gelir. En düşük enerjili üçlü durumu T 1 (enerji diyagramına bakın), daha enerjik T 2 , T 3 vb. Olarak adlandırılır. Tekli durumdan üçlü duruma geçiş , sistemler arası geçiş olarak adlandırılır . Bu geçiş sırasında, bir elektronun spininin dönmesi gerekir, böylece eşleşmemiş bir elektron spinleri kümesi mevcut olur. Bu olasılığı düşüktür, genellikle, fakat önemli ölçüde artırır molekülü, yani, daha yüksek uyarılmış durumdan birinde olduğu S olduğunda 2 veya daha yüksektir. Üçlü durumları için bir geçiş olasılığını, S uyarma en aza indirmek için 2 floresans üçlü durumları ve bu durumlar ortaya çünkü eğer mümkünse kaçınılmalıdır veya daha uzun ömürlü.
Üçlü halden, elektron ya temel durumuna dönmek için enerjisini ısı olarak verebilir ya da bir foton verir. Bu foton, uyarılmadan çok sonra floresan olarak ortaya çıkar; bu fosforesandır .
Bununla birlikte, üçlü durumdan, florokrom da yok edilebilir, yani ağartılabilir . Uyarılmış tekli hallerin aksine, üçlü haldeki bekleme süresi önemli ölçüde daha uzundur, bu nedenle çevredeki diğer moleküllerle kimyasal olarak reaksiyona girme olasılığı daha fazladır. Floresan boya kimyasal olarak reaksiyona girmişse, reaksiyon ürünü genellikle floresan değildir ve boya ağartılır. Moleküler oksijen O 2 ile reaksiyon, üçlü temel duruma sahip olduğundan ve üçlü-üçlü reaksiyonlar çok etkili olduğundan özellikle önemlidir .
Bu nedenle, terkipten oksijen çıkarılırsa ağartma azaltılabilir. Bu, indirgeyici bir etkiye sahip olan sözde anti-ağartıcı maddelerle (ağartma önleyici maddeler için İngilizce) sağlanabilir . Para-fenilamin diamin, DABCO veya gallat gibi antioksidanlar kullanılır . Ancak ağartma tamamen engellenemez. Bu nedenle, floresan etiketleme için mümkün olduğunca fotostabil olan florokromların seçilmesi önemlidir.
Fototoksisite
Önceki bölümde açıklanan reaksiyonlar, canlı hücrelerin veya organların floresan mikroskopisinde de meydana gelir. Burada sadece ağartma meydana gelmez, aynı zamanda oksijenle reaksiyon sırasında ortaya çıkan reaktif oksijen türleri, sonraki bir reaksiyonda hücresel bileşenlere zarar verebilir ve böylece hücrenin ölümüne yol açabilir. Askorbik asit veya troloks gibi indirgeyici maddelerin eklenmesi burada da yardımcı olabilir .
Kısa dalgalı ışık, özellikle UV ışığı, flüoresansa neden olmadan hücrelere doğrudan zarar verebilir. Bu, cıva buharlı lambalar gibi geniş spektrumlu ve yüksek UV içeriğine sahip ışık kaynakları ile ilgili bir sorun teşkil eder . Filtreler, ışık kaynağının yüksek UV bileşenini tamamen engelleyemez. Bu nedenle, LED'ler, lazerler veya halojen lambalar gibi UV içermeyen ışık kaynaklarının kullanılması canlı gözlemler için avantajlıdır.
İlgili soru için maruziyet mümkün olduğu kadar düşük tutulursa her iki sorun da azalır. Özellikle hassas kameralar veya diğer dedektörler de buna katkıda bulunabilir. Reaktif oksijen türlerinin oluşumu, görüntü alanı (hücreler) araması ve odaklanma flüoresan ile değil, parlak alan, faz kontrastı , diferansiyel girişim kontrastı veya benzer yöntemlerle gerçekleştirilirse ve böylece floresan mikroskobik inceleme azaltılırsa azaltılabilir. minimuma.
Belirtilen fototoksik etkilere ek olarak, floresan etiketleme için kullanılan maddelerin aşırı konsantrasyonları, hücrelerin doğrudan zehirlenmesine neden olabilir.
Bitişik renk kanallarında sinyallerin karışması
Olarak bleedthrough (İngilizce hava alma kılavuz için) ya da çapraz-karışma bir sinyal da birden fazla seçim bitişik renk kanalında görülmektedir zaman, yani çapraz-karışma, olarak adlandırılır. Çoğu florokromun emisyon spektrumunun uzun dalga ucu, sıfıra doğru çok yavaş düşer. Bu nedenle, spektrumdaki komşu florokromların eşzamanlı uyarılması ve tespiti ile, örneğin komşu turuncu renkli kanalda yeşil bir florokrom gibi sıklıkla çapraz karışma meydana gelir. Dar bant geçiren filtreler kullanılırsa ve / veya boyalar aynı anda değil, birbiri ardına uyarılırsa bu önlenebilir veya en azından azaltılabilir.
Yaşam bilimlerinde hazırlık ve uygulamaların hazırlanması
Floresan mikroskobu yaygın olarak kullanılmaktadır içinde yaşam bilimleri . İncelenecek bazı nesneler doğal olarak floresandır. Bu, otofloresans olarak bilinir . Örneğin bitkiler, klorofillere ve doğal olarak floresan ışığı veren diğer pigmentlere sahiptir. Bununla birlikte, otofloresans genellikle istenmeyen bir durumdur çünkü arka plan flüoresansı olarak yapay flüoresansın tespitini daha zor hale getirir.
Bir floresan etiketleme yöntemleri çeşitliliği geliştirilmiştir için biyomedikal uygulamalarda. Bazı floresan boyalar, kimyasal özelliklerinden dolayı incelenecek yapıya doğrudan bağlanır. Bu grup, örneğin DAPI , akridin turuncusu ve Hoechst 33342 gibi DNA boyalarını veya Nil kırmızısı veya DiI gibi membran boyalarını içerir . Bu boyalardan bazıları canlı hücreleri de lekeleyebilir.
Diğer durumlarda, araştırılan yapıya bağlanan floresan olmayan bir molekül, bir floresan boya ile kimyasal olarak birleştirilir. Bu yaklaşımın örnekleri, floresan etiketli antikorların kullanıldığı immünofloresan , floresan in situ hibridizasyon , daha büyük DNA bölümlerinin mikroskobik tespiti için bir teknik veya flüoresans etiketli falloidin ile aktin boyamadır .
Proteinler edilebilir genetik kaynaşık gibi bir floresan protein GFP . Floresan mikroskobik görüntüden, araştırılan proteinin canlı ve çoğunlukla sabit hücrede ( örneğin hücre çekirdeğinde , sitoplazmada , hücre zarına bağlı veya dışa aktarılmış) dağılımı ve düzenlenmesi hakkında sonuçlar çıkarılabilir veya hücre bileşenleri kendi spesifik proteinleri ile görselleştirilebilir (aktin yoluyla aktin filamentleri veya tübülin yoluyla mikrotübüller gibi ). Proteinler arasındaki etkileşimler, farklı floresan proteinlerle kaynaştıklarında da gözlemlenebilir. Floresan proteinler, belirli hücre tiplerini tanımlamak için ifade edilen hücre tipine özgü bir promotörü de kontrol edebilir .
Diğer bir grup, floresan davranışı ortamınızın durumuna bağlı olarak değişen problardan oluşur. Kalsiyum gibi bağımlı boyalar Aequorin , fura-2 , furaptra , kalsein ve indo-1 bir hücre içinde kalsiyum iyonlarının konsantrasyonu dalgalanmaları gösterebilir. Bir hücrede gerilim değişiklikleri görüntülenebilir ile voltaj-bağımlı boyalar ya da bir raportör protein VSFP veya DİKME. İle redoks -duyarlı raportör proteinleri, rogfp , rxYFP veya hiper olabilir potansiyel redoks takip edilmektedir. Floresan pH göstergeleri , bir hücrede farklı pH değerleri gösterebilir .
- Floresan mikroskobu görüntüleri
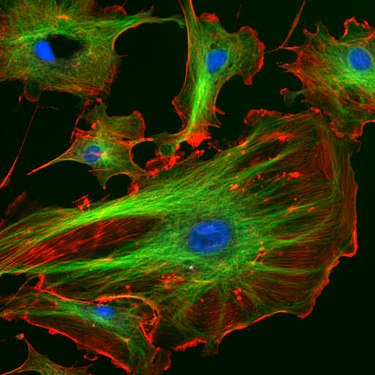
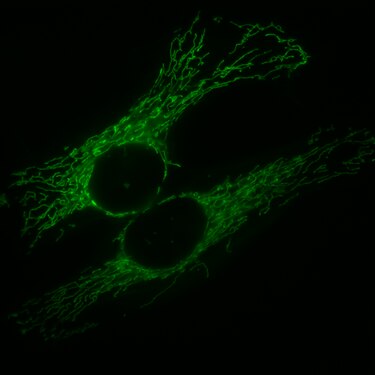
Floresan mikroskobu altında endotel hücreleri. Mikrotübülüsleri (yeşil olan FITC- , etiketli antikor) filamentler aktin (ile kırmızı olan Phalloidin - TRITC ). DNA, içinde hücre çekirdekleri DAPI (mavi) ile boyanmıştır.
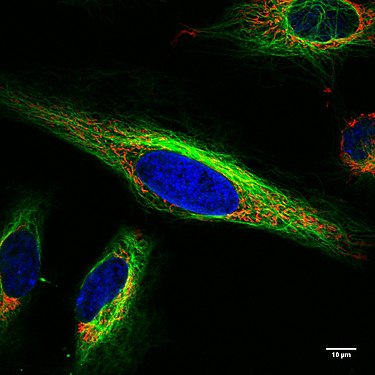
Konfokal mikroskop altında yaşayan HeLa hücreleri . Mitokondri kırmızı, hücre çekirdeği mavi, mikrotübüller yeşil.
Sonunda Hücre mitoz bölünme içinde telophase . Kromozomlar mavi (DAPI), mikrotübüller kırmızı, INCENP proteini , GFP ile füzyon nedeniyle yeşil renklidir.
Sıçan omurga ganglionunda immünofloresan görüntüsü . Kırmızı veya yeşil floresan markörlerle iki farklı protein boyandı.
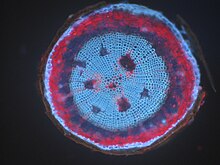
Chromomycin A3 ile boyanmış bir dişi insan lenfositinden elde edilen metafaz kromozomları .
Bir fare fibroblastının hücre çekirdeği, kromozom 2 (kırmızı) ve 9 (yeşil) bölgeleri, floresan in situ hibridizasyon ile boyandı. Mavi DNA zıt boyama.
Mitokondri olan HeLa hücreleri, karşılık gelen bir sinyal peptidiyle kaynaşmış GFP ile işaretlenir .
Malzeme bilimindeki uygulamalar
Yaşam bilimlerinin aksine, floresan boyalar malzeme biliminde nadiren kullanılmaktadır. Floresan mikroskopi kullanımı çoğunlukla malzemenin otofloresan olduğu durumlarda sınırlıdır. Örneğin, kompozit malzemelerin bazı bileşenleri floresandır ve diğer floresan olmayan bileşenlerden ayırt edilebilir. Durumun daha iyi bir temsili için, floresan bir konfokal mikroskopta yansıma ile birleştirilebilir. Bu, flüoresan bağlayıcıların (baz polimer), örneğin fiberglasla güçlendirilmiş kompozit malzemelerdeki floresan olmayan fiberlerden ayırt edilebileceği anlamına gelir .
Kâğıt , odun veya sakatta bulunan organik lifler , dizilişlerini veya bileşimlerini belirlemek için bir dizi çalışmada incelenmiştir.
Bir floresan mikroskobu kullanılarak farklı güneş pilleri de incelenebilir. Konfokal floresan mikroskobu sıklıkla, aynı zamanda konfokal yansıma mikroskobu ile kombinasyon halinde kullanılır. Olarak , organik güneş hücreleri , floresan organik bileşenlerin kaybı araştırılabilir hücrenin içine oksijen ile oksidasyon neden olduğu; bozunma ürünlerinin floresan olmaması şartıyla. Işığın aynı adı taşıyan perovskit tabakasının oluşumu üzerindeki etkisi perovskit güneş pillerinde analiz edildi .
Bir dizi mineral floresan olmasına rağmen, floresan mikroskobu petrolojide çok az kullanılır. Dikkate değer bir istisna, kömür ve tortulardaki organik kapanımların incelenmesidir . Saf mineraller genellikle floresan değildir, ancak flüoresans çeşitli inorganik veya organik safsızlıklardan kaynaklanabilir. Organik kökenli kömürün bu tür kaya oluşturan bileşenlerine maseral denir . Bir alt grup, lipit bakımından zengin liptinitlerdir. Bu floresan bileşenler, özellikle cilalı yüzeylerde floresan olmayan inorganik bileşenlerden mikroskobik olarak ayırt edilebilir. Kömürün oluşumu sırasında, flüoresan özellikleri değişir, böylece farklı tortulardan malzemeler ayırt edilebilir.
Özel floresan mikroskobik prosedürler
Işık disk mikroskobu
Gelen ışık tabaka floresan mikroskobu ( İngilizce ışık tabaka mikroskopisi , aynı zamanda hafif bir levha mikroskobu ya da bir uçak ışıklandırma mikroskopi bir şekilde, SPIM) gelen uyarım ışığı mercek veya ışığı tabaka ışınlanmış. Bu, ikinci bir objektif veya gözlem hedefine dik olan ve numunenin dar sınırlandırılmış bir düzlemini aydınlatan karşılık gelen bir silindirik mercek kullanılarak yapılabilir . Floresans yalnızca bu aydınlatılmış bölmede üretilir ve bu düzlem, gözlem merceğinde odak haline getirilir. Diğer düzlemlerde, bu nedenle, normal floresans mikroskopisinde kontrastta bir azalmaya yol açacak şekilde bulanık arka plan floresanı üretilmez. Yöntem, ışık tabakasının gözlem merceğinin alan derinliğinden daha ince olması durumunda normal bir floresan mikroskobunun eksenel çözünürlüğünü iyileştirmeyi mümkün kılar . İnceleme nesnesinin yan aydınlatması, yarık ultrasonik mikroskoptaki düzenlemeye benzer .
Konfokal ve iki fotonlu floresan mikroskobu
Konfokal ve iki foton mikroskopları ile numune taranır: Uyarma ışığı bir noktaya odaklanır, bu noktadan gelen floresan detektöre ulaşır. Nokta numune üzerinde hareket ettirilir ve her durumda ölçülen floresan yoğunlukları, bir kontrol bilgisayarında bir görüntü oluşturmak için birleştirilir.
Konfokal floresan mikroskobu ile, odak düzleminin üstündeki ve altındaki aydınlatma konisinde flüoresans da üretilir. Ancak bu , ara görüntü düzlemindeki bir iğne deliği tarafından engellendiği için detektöre ulaşmaz . Bu arka plan floresanını bloke ederek, odak düzlemindeki sinyal, klasik floresan mikroskobuna göre arka plandan daha iyi ortaya çıkar. Bu açıkça daha yüksek kontrastlı görüntüler nedeniyle, eş odaklı mikroskoplar biyolojik araştırmalarda yaygın olarak kullanılmaktadır.
Bir floresan boya olabilir , aynı zamanda olarak uyarılmış ile iki fotonlu emilime yerine alınması ile bir foton . Bunun ön koşulu, bu iki fotonun flüoresan boyaya neredeyse aynı anda ulaşması ve her ikisinin birlikte boyanın bir elektronunu uyarılmış bir enerji seviyesine yükseltmek için doğru enerji içeriğine sahip olmasıdır. Eksitasyon için, uyarılacak flüoresan boyaya bağlı olarak yüksek yoğunlukta 700 ile 1200 nm arasında dalga boyları oluşturan darbeli bir lazer kullanılırsa her iki koşul da karşılanabilir ve bu ışık objektif tarafından bir noktaya odaklanır. Foton yoğunluğu o kadar yüksektir ki, iki fotonun aynı anda flüoresan moleküle ulaşması için yeterli bir olasılık vardır. Okuma hacminin sınırlı olduğu eş odaklı mikroskopinin aksine, uyarma hacmi burada sınırlıdır. Daha uzun dalgalı ışık, biyolojik dokuya daha büyük ölçüde nüfuz eder, çünkü bunlar tarafından daha az güçlü bir şekilde emilir ve ayrıca daha az güçlü bir şekilde dağılır . Bu nedenle, iki fotonlu floresan mikroskobu, diğer yöntemlerle mümkün olandan daha derin dokuya nüfuz etmek için kullanılır. Floresansa dayanmayan yöntemlerin yanı sıra, bu prosedür çok tonlu mikroskopi veya doğrusal olmayan mikroskopi olarak bilinir.
Floresans korelasyon spektroskopisi
Floresans korelasyon spektroskopisi ( floresan korelasyon spektroskopisi için FCS olarak kısaltılır ), floresan mikroskobik bir yöntemdir, ancak bir görüntü oluşturmaz. Konfokal bir mikroskopta, uyarma lazeri numune üzerinde taranmaz, tek bir yere park edilir. Bu nedenle, daha uzun bir süre boyunca çok küçük bir hacim gözlemlenir. Floresan molekülleri bu hacmin içine veya dışına hareket ederse, ölçülen parlaklık değişir. Ölçümlerin gibi bir dizi molekülleri kadar hızlı bir şekilde belirlemek için, örneğin, kullanılabilecek yaygın bir çözelti içinde . Difüzyon hızı, diğer şeylerin yanı sıra boyuta bağlı olduğundan, örneğin, flüoresan etiketli bir proteinin solüsyonda bulunan ikinci bir proteine bağlanıp bağlanmadığını ve dolayısıyla daha yavaş hareket edip etmediğini araştırmak mümkündür.
Yüksek çözünürlüklü süreç
In mikroskobu, çözünürlük ayrı yapılar olarak algılanmasına iki yapının sırayla sahip olması gereken mesafedir. Ernst Abbe , 19. yüzyılda bu kararın temelde kırınımla sınırlı olduğunu anlayan ilk kişiydi . Bu sınır, bu nedenle Abbe sınırı olarak adlandırılır. Uygun formüller kullanılarak tam olarak hesaplanabilir ve yağa daldırılan iyi mikroskoplar için ve dalga boyuna bağlı olarak yaklaşık 200 nm'dir.
Abbe sınırı uzun süredir aşılamaz olarak kabul edildi. Bununla birlikte, 20. yüzyılın ikinci yarısından itibaren, çözünürlüğü Abbe sınırının öngördüğünden daha iyi olan bazı mikroskobik yöntemler geliştirildi. Bu yöntemlerin en eskisi, konfokal mikroskopidir (ayrıca Konfokal mikroskop makalesinde çözünürlükle ilgili bölüme bakın.) Bununla birlikte, teorik gelişme sadece 2 ≈ 1.41 faktör kökü ile olur. Pratik nedenlerden dolayı buna da ulaşılamaz.
1980'lerde TIRF mikroskobu ( İngilizce toplam dahili yansıma floresan mikroskobu önerildi). Yalnızca örnekteki lama kağıdına çok yakın olan floresan boyaları harekete geçirir. Müstahzar, örneğin canlı hücreler, sulu bir ortam içindeyse, lamelden gelen eksitasyon, yalnızca 100-200 nm kalınlığındaki bir tabakaya nüfuz eder. Bu nedenle katman kalınlığı, kırınım nedeniyle normal mikroskopi ile mümkün olandan önemli ölçüde daha azdır. Bu, önemli ölçüde daha yüksek bir kontrastla sonuçlanır, çünkü yalnızca küçük bir miktar malzeme floresan için uyarılır. Bu özel uyarma biçimi, numuneyi, kapak kaymasından sulu ortama kenarda toplam yansıma meydana gelecek ve ışık ışını numuneye hiç girmeyecek kadar büyük bir açıyla aydınlatarak elde edilir . Bununla birlikte, kenarda, uyarılmaya neden olabilen, ancak lamelden olan mesafe arttıkça çok hızlı bir şekilde zayıflayan bir dalga oluşur .
Tanım gereği "çözünürlük" iki yapı arasındaki minimum mesafe anlamına gelirken, bir nesnenin tam konumu çok hassas bir şekilde ölçülebilir. Floresan mikroskobu bu nedenle, nesnelerin farklı renk kanallarındaki tam konumunu belirleyerek ve ardından aralarındaki mesafeyi ölçerek Abbe sınırını aşabilir. Bu teknik 1990'larda geliştirildi ve daha sonra Spektral Hassas Mesafe Mikroskobu (SPDM) olarak anıldı. Küçük floresan yapılar arasındaki mesafeleri yaklaşık 70 nm hassasiyetle ölçmek için kullanılabilir. Bununla birlikte, kaydedilen renk kanallarının her biri kırınıma maruz kaldığından özünürlükte genel bir iyileşmeye yol açmaz.
Ancak 20. yüzyılın sonu ve 21. yüzyılın başında genel bir iyileştirmenin mümkün olduğu bazı yöntemler geliştirildi. Toplu olarak İngilizce'de süper çözünürlük mikroskobu , bazen de nanoskopi olarak anılırlar . Hepsinin ortak noktası, floresan mikroskopisine dayanmalarıdır. Bu yöntemlerden üçü bir miktar popülerlik kazanmıştır ve ticari olarak temin edilebilir: STED, yapılandırılmış aydınlatma ve lokalizasyon mikroskobu. Yukarıda belirtilenlere karşı kendine hakim olamayan veya şimdiye kadar sadece bireysel gruplar tarafından kullanılan başka yöntemler de vardır. Bazı prosedürler, ortak özelliklerinden dolayı RESOLFT mikroskobu olarak gruplandırılmıştır.
Yüksek çözünürlüklü floresan mikroskobu, Nature Methods dergisi tarafından 2008 Yılının Yöntemi olarak adlandırılmıştır . William Moerner , Eric Betzig ve Stefan Hell , bu yöntemlerden bazılarını geliştirdikleri için 2014 Nobel Kimya Ödülü'nü aldı .
STED mikroskobu

In STED'in mikroskobu ( İngilizce emisyon tükenmesi uyarılmış olan) kırınım sınırı belirgin üstesinden gelir. Numunede kırınımla sınırlı bir hacmin uyarılmasını, daha uzun bir dalga boyuna sahip ışıkla halka şeklinde bir uyarılma izler. Uyarma alanındaki uyarılmış moleküller, uyarılmış emisyon yoluyla temel duruma geri döner. Floresans yayan hacim böylece önemli ölçüde azaltılır ve mikroskobun çözünürlüğü artar.
Yapısal aydınlatma
Yapılandırılmış aydınlatma veya 3D-SIM mikroskobu (İngilizce yapılandırılmış aydınlatma mikroskobu ) ile, tüm florokromlar uyarılır, ancak hazırlığın yalnızca belirli bir 'yapı', çizgili bir desen formundaki bir kısmıdır. Bilinen aydınlatma modeli, numunedeki bilinmeyen florokrom dağılımı üzerine bindirildiğinde , bilinmeyen yapı daha küçük olsa bile boyutu çözünürlük sınırından daha büyük olan hareli etkiler meydana gelir . Aydınlatma düzenini kaydırarak ve döndürerek, ilgili görüntülerin hareli desenlerinden gelen ek bilgiler, iki katına kadar çözünürlükle nihai bir görüntü oluşturmak için hesaplanabilir.
Lokalizasyon mikroskobu
Lokalizasyon mikroskobu, ortak bir temel prensibe dayanan mikroskobik prosedürleri özetlemek için kullanılan terimdir : klasik floresan mikroskobu ile tüm florokromlar aynı anda heyecanlanır, burada birbiri ardına heyecanlanırlar, böylece bunların sadece küçük bir kısmı her zaman aydınlatılır. Pek çok fotoğraf, genellikle binin üzerinde olmak üzere, bir odak seviyesinden birbiri ardına çekilir. Parlayan florokromların tam konumu artık bu görüntülerin her birinde belirlenir ve bu konum son görüntüye aktarılır. Prosedürler, tek tek boya moleküllerinin nasıl açılıp kapatıldıkları, yani "yanıp sönecek" hale getirildikleri yöntemde farklılık gösterir.
Fotoaktive yerelleştirme mikroskobu (PALM) varyantları dayanmaktadır yeşil floresan protein , belirli dalga boylarındaki ışık ile bir ve salmak. STORM ve dSTORM, belirli tampon çözeltilerde nadiren floresan veren uygun floresan boyalar kullanır. Temel Durum Tükenmesi (GSD), herhangi bir zamanda florokromların çoğunun, güçlü ışık uyarımı ile oluşturulabilen, floresan olmayan üçlü bir durumda olduğu gerçeğine dayanır. DNA-Paint , kısa, tek sarmallı DNA moleküllerinin tamamlayıcı hedef moleküllere geçici olarak bağlanmasına dayanır .
Çözünürlüğü iyileştirmek için diğer yöntemler
4Pi mikroskobu , ticari olarak temin edilebilen ilk süper çözünürlük tekniğiydi, ancak bugün artık mevcut değil. Diğer bir teknoloji ise Heidelberg'de geliştirilen Vertico-SMI'dır .
Floresan Ömür Boyu Mikroskopi (FLIM)
Uyarıldıktan sonra, bir floresan madde, floresan ışığı yaymadan önce kısa bir süre uyarılmış durumda kalır. Bu sürenin süresi, belirli bir aralıktaki belirli bir maddeye göre değişir, böylece belirli bir madde için ortalama bir floresan ömrü belirlenebilir. Nanosaniye aralığındadır, örneğin 3.25 ns'de floresan için, 3.41 ns'de Texas Red için ve 1.1 ns'de eozin için. Mikroskobik preparasyonda flüoresans uyarımı, darbeli veya modüle edilmiş bir lazer ile gerçekleşiyor ve özel dedektörler kullanılıyorsa, floresanın detektöre ulaştığı zaman aralığı özel ölçüm yöntemleri ile belirlenebilir . Floresan boyalar bu nedenle birbirinden yalnızca renkleriyle değil aynı zamanda ömürleriyle de ayırt edilebilir. Bu, floresan ömür boyu mikroskobu (İngiliz floresan ömür boyu görüntüleme mikroskobu , FLIM) istismar edilmiştir. Darbeli ve modüle edilmiş lazerler, bir foton ile uyarma için görünür dalga boyu aralığında mevcuttur. FLIM, yine de darbeli lazerlerin gerekli olduğu çoklu foton uyarımı (yukarıya bakın) ile kombinasyon halinde de kullanılabilir.
Förster Rezonans Enerji Transferi (FRET)
Förster rezonans enerji transferi ile (bazen: flüoresan rezonans enerji transferi), uyarılmış bir flüoresan boyanın, yani donörün enerjisi flüoresan tarafından verilmiyor, doğrudan başka bir flüoresan boyaya (alıcı) aktarılıyor. Bu, ilk olarak, verici ve alıcı birbirinden 10 nm'den daha az ise ve ikinci olarak, vericinin emisyon enerjisi, alıcının uyarma enerjisine karşılık gelirse mümkündür. Vericinin emisyon spektrumu bu nedenle alıcının uyarma spektrumu ile örtüşmelidir. Örneğin, yeşil bir floresan boya, turuncu bir floresan alıcısı için bir verici görevi görebilir. Başka bir örnek, sarı floresan protein YFP için bir donör olarak camgöbeği floresan protein CFP'dir.
FRET oluşursa, vericinin uyarılmasına rağmen donör tarafından floresan yayılmaz; bunun yerine, alıcının floresansı gözlemlenebilir. FRET verimliliği, verici ile alıcı arasındaki mesafenin altıncı kuvveti ile azalır. FRET'in ortaya çıkması, bu nedenle, çözünürlük sınırının çok altında bir doğrulukla ikisinin doğrudan yakınlığını gösterir.
Difüzyon ölçümü için kasıtlı ağartma (FRAP ve FLIP)
FRAP'de ( foto ağartmadan sonra floresan geri kazanımı ), canlı bir hücrede floresan etiketli bir molekül, genellikle odaklanmış bir lazer ışınıyla kısa süreli, güçlü ışığa maruz bırakılarak hücrenin bir bölümünde kasıtlı olarak ağartılır. Daha sonra hücrenin ağartılmamış kısmından moleküllerin ağartılmış kısma ne kadar hızlı geri döndüğü gözlemlenir. Molekülün bağlanma davranışı ile ilgili sonuçlar, belirlenen difüzyon hızından çıkarılabilir.
FLIP ( foto ağartmada floresans kaybı ) ile diğer yandan hücrenin bir alanı sürekli olarak ağartılır. Hücrenin ağartılmamış kısmında floresanın ne kadar hızlı azaldığı gözlenir.
Tarih
1904: Köhler'in keşfi
İlk floresan mikroskobik gözlemler tesadüfi ve rahatsızlık vericiydi. Mikroskop üreticisi Carl Zeiss'in çalışanı August Köhler , ışık mikroskobik çözünürlüğünü artırmak istedi. Çözünürlük dalga boyuna bağlıdır, bu yüzden UV ışığının daha kısa dalga boyunu kullanması için bir mikroskop yaptı . Bu şekilde oluşturulan görüntü gözler tarafından görülemiyordu, ancak fotoğraf olarak çekilebiliyordu. Bunu buldu
“Nesnenin kendisi, kendisine çarpan ultraviyole radyasyonun etkisi altında floresan ışıldar. Bu tür floresans, örneklerin çoğunda görülür. ... Floresan ışık ... her halükarda kısmen spektrumun görünür aralığındadır; ... Bunun, ultraviyole ışınlarının ürettiği görüntüyü algılamayı imkansız değilse de zorlaştırdığı açıktır. aslında önemli. ... Elbette belirli koşullar altında, bu doğrudan görüntünün gözlemlenmesi de ilgi uyandırabilir ... "
Bu nedenle Köhler, UV mikroskobunda yıkıcı bir faktör olan flüoresansın da faydalı uygulamaları mümkün kılabileceğinin erken farkındaydı.
1910-1913: İlk floresan mikroskopları ve uygulamaları
Piyasada satılan ilk floresan mikroskobu, Viyanalı mikroskop üreticisi Karl Reichert'in bilgi işlem ve tasarım ofisinin başında bulunan Oskar Heimstädt tarafından geliştirildi . Kişisel olarak Reichert tarafından 1911'de Alman doğa bilimcileri ve doktorların toplantısında sunuldu . Aynı yıl Heimstädt, bilimsel mikroskopi dergisinde "Floresan mikroskobu" başlıklı bir çalışma yayınladı.
UV ışığı, gözle görülemediğinden ve bu nedenle bloke edici filtre gerekmediğinden, floresan uyarımı için çok uygundu. İyi bir uyarı, ışık kaynağından görünür UV ışığının olmamasını, ancak mümkün olduğunca çok UV ışığının numuneye ulaşmasını gerektiriyordu. Kısa bir süre önce, 1910'da Zeiss'te Hans Lehmann tarafından uygun bir uyarma filtresi geliştirildi. Optik eksen boyunca iki bölmeden oluşan bir filtre küvetinden oluşuyordu. Üç duvar Jena mavi uviol camdan yapılmıştır , bir oda doymuş bakır sülfat solüsyonu, diğeri seyreltik nitrosodimetilanilin solüsyonu ile doldurulmuştur. Bu şekilde üretilen uyarma ışığı, "filtrelenmiş ultraviyole" olarak adlandırıldı. Normal cam UV ışığını absorbe ettiğinden, yüksek aydınlatma seviyeleri elde etmek için bir süre sonra bir kuvars yoğunlaştırıcı kullanıldı. Ancak, yeni bir sorun ortaya çıktı: Hedefteki cam lensler floresan ışığı almaya başladı. Lehmann bu nedenle bir karanlık alan yoğunlaştırıcı kullandı : Uyarma ışığı merceğin önünden geçirildi ve mikroskobik görüntüde ışık kaynağından gelen görünür ışığın kalıntıları da önlendi.
Heimstädt, floresan mikroskobunun olanakları ve gelecekteki beklentileri hakkında yazdı
"Bu Z. Örneğin , unda çok az miktarda ergot varlığını tespit etmek kolaydır ... çünkü nişasta yoğun şekilde mor floresan ışıldarken ergot sarımsı beyaz bir ışık yayar. ...
Gelecek bize flüoresan mikroskobunun ... mikroskobik görüntüleme alanını genişletme olasılığını [içerdiğini] ve ne kadarını öğretmelidir.
Ayrıca 1911'de Michail Tswett kloroplastların floresansını tanımladı . 1913 yılında Stanislaus von Prowazek , floresan boyaların kullanıldığı ilk çalışmayı, yani eozin ve nötr kırmızıyı yayınladı .
Reichert'in floresan mikroskobundan bir yıl sonra, Lehmann tarafından geliştirilen Zeiss “lüminesans mikroskobu”, 1912'de Alman doğa bilimcileri ve doktorların bir araya gelmesinde sunuldu. Karanlık alan aydınlatması, sayısal açıklığın azalmasına ve dolayısıyla çözünürlüğün azalmasına neden olur . Bu nedenle Lehmann, UV ışığı ile normal parlak alan aydınlatmasına güveniyordu. UV ışığının göze nüfuz etmesini önlemek için, kapak slipi olarak kullanılan Euphos camdan yapılmış UV bloke edici bir cam filtre kullandı . Hedefte floresan uyarımını önlemek için filtrenin numune ile hedef arasında olması gerekiyordu, bu nedenle filtre için başka bir konum mümkün değildi. Kondansatörde kuvars lensler vardı ve kullanılan mikroskop lamları UV iletimini sağlamak için kaya kristalinden yapılmıştır . Önerilen standart büyütme oranı 62 × (oküler büyütme dahil), 300 × aşılmamalıdır. Gerçek mikroskop olmadan ek floresans ekipmanı, en ucuz uyarma ışık kaynağı, manuel olarak ayarlanabilen bir ark lambası ile yaklaşık 500 mark tutmaktadır . Ayrıca 0,5 mm kalınlığında 30 × 25 mm kaya kristali slayt için 4,50 M ve Euphos cam kapak şeridi başına bir işaret vardı. Siyah beyaz fotoğraflarına ek olarak, renkli görüntüler de olabilir oluşturulan kullanarak Autochrome sürecini.
1933–1940: Max Haitinger ve florokromlama

Floresan mikroskobunun ilk günlerinde, otofloresan nesneler neredeyse yalnızca incelendi. Max Haitinger bile , Viyana yakınlarındaki Weidling'de ve daha sonra Viyana Üniversitesi'nde ilk özel araştırmacılar , şarap ve meyve şaraplarının floresansını inceleyerek işe başladı. Ancak 1933'ten itibaren "florokrom" adını verdiği floresan lekeler geliştirdi. Üretilecek sinyaller için ikincil floresan ve preparatta doğal olarak mevcut olanlar için birincil floresan terimleri ondan gelir. Ayrıca bir floresan boya için florokrom terimini de tanıttı. İlk olarak bitki özlerini florokrom olarak ve daha sonra bir dizi kimyasal kullandı. Bu, hayvan ve insan dokularının ince kesitlerini boyamasını sağladı, böylece histologlar da floresan mikroskobu ile ilgilenmeye başladı. Florokromların yalnızca çok düşük konsantrasyonları gerektiğinden, esas olarak botanikte kullanılan canlı lekeler de mümkündü. İle auramin O yönetilen boyama tüberküloz bakteri. Çoklu boyama da mümkündü. Haitinger 1934'te ilk makalesini yayınladı, "Fluorescenzmikoskopie - Histoloji ve kimyadaki uygulamanız" adlı kitabı 1938'de yayınlandı.
Haitinger, floresan mikroskoplarını geliştirmek için Reichert ile yakın bir şekilde çalıştı. Yeni model "Kam F" 1931'den itibaren satıldı. Bunda da ışık kaynağı olarak demir elektrotlu bir ark lambası vardı, çünkü bu lamba 300 nm ile 400 nm arasında nispeten yüksek bir UV bileşenine sahipti. Yine de fotoğrafları için 20 dakikaya kadar pozlama süresine ihtiyacı vardı. Düşük büyütmeler için, karbon ark lambaları ile bir ila on dakikalık pozlama sürelerinden bahseder. Eksitasyon filtre küvetindeki nitrosildimetilanilin solüsyonu, nikel oksit içeren siyah cam filtrelerle değiştirilebilir. Kalan kırmızı bileşeni uyarma ışığında filtreleyen bakır sülfat çözeltisi, 1940'ların başına kadar mavi cam filtrelerle değiştirilmedi. Aydınlatma, normal camlı bir parlak alan yoğunlaştırıcı ile gerçekleştirildi; bunun için kuvars camının gerekli olmadığı görülmüştür. Kalan uyarma ışığı, 1 mm kalınlığında sarı camdan yapılmış bir engelleme filtresi takılarak göz merceğinde bloke edildi. Renksiz bir bariyer filtre gerekiyorsa, bunun yerine 5 mm kalınlığında sodyum nitrit çözeltisi içeren bir küvet kullanılabilir. Sarı blokaj filtresi sayesinde artık Euphos camından yapılmış kapak camlarına gerek kalmadı ve normal mikroskop lamlarının uygun olduğu da gösterildi. Bu, işletme maliyetlerini önemli ölçüde düşürdü.
Onun 1938 kitabında, Haitinger E. gelen Zeiss Jena, Epilum Optik İşleri C Reichert-Wien (şematik bir çizim), Ultropak den Epicondensor (opak nesnelerin floresan mikroskobu için, gelen ışık aydınlatmaları tarif Leitz-Wetzlar gelen ve Univertor E Busch-Rathenow ). Bununla birlikte, bir dikroik ışın ayırıcı kullanarak bugünün gelen ışık floresan uyarımı ile karşılaştırılamazlar. Uygulama örnekleri olarak, ince kesitlerin üretileceği müstahzarların ilk incelemelerinin yanı sıra gıda, ilaç ve boyaların incelenmesinden bahsediyor . Canlı hayvanlar üzerinde yapılan araştırmalar için olay ışıklarının aydınlatılmasını "özellikle değerli" olarak nitelendiriyor.
1940 civarında Osram , süper yüksek basınçlı cıva lambalarını pazara sundu; bunun için aydınlatma ekipmanı kısa süre sonra Zeiss ve Haitinger'in ortak geliştirmesiyle Reichert'te (Lux UV ve Lux UW) ürün yelpazesine eklendi. Önemli ölçüde basitleştirilmiş kullanım ve daha fazla parlaklığa ek olarak, bu lambalar yalnızca tek tek çizgiler yaymakla kalmadı, aynı zamanda tüm floresan maddelerin uyarılabildiği sürekli bir spektrum da yaydı. Demir ark lambaları gibi hoş olmayan dumanlar da üretmediler. Benzer lambalar bugün hala kullanılmaktadır.
1940'larda renkli slayt film, dokümantasyon amacıyla kabul görmeye başladı . Tüm ilerlemeye rağmen, pozlama süreleri çoğunlukla hala iki basamaklı dakika aralığındaydı.
1942–1958: İmmünofloresanın gelişimi ve geleneksel boyaların floresansı
Floresan mikroskobu için bir dönüm noktası, immünofloresanın tanıtılmasıydı . 1942 yayınlanan Albert Coons ve bağlama arkadaşları floresein - izosiyanat için antikorlar . Parlak yeşil floresansı ile bu florokrom, birçok dokunun mavimsi otofloresanından daha önce denenmiş antrasen izosiyanata göre daha iyi göze çarpıyordu . Antikorlar, flüoresan mikroskobu ile fare dokusunda tespit edilebilen pnömokoklara yöneliktir . Bununla birlikte, antikorların bağlanması teknik olarak zahmetliydi ve konjugatlar kararsızdı.
Siegfried Strugger , nötr kırmızı ve rodamin B gibi bilinen bazı geleneksel boyaların da floresan ışığı verdiğini belirtti . Ayrıca floresan mikroskobu için akridin portakalı kullandı. 1949'da bir kitapta UV yerine mavi ışıkla floresan uyarma olasılıklarını ayrıntılı olarak anlattı. Strugger, bitkilerdeki su akışını izlemek için olay ışığını kullandı.
1958'de JL Riggs ve arkadaşları tarafından izosiyanatlar yerine izotiyosiyanatlar kullanılarak immünofloresansta önemli bir gelişme sağlandı . Bu arada başka bir çalışma grubu, floresan izosiyanat ve turuncu floresan rodamin B izosiyanat ile iki rengi tespit etmeyi başardı. Riggs ve meslektaşları artık antikorları çok daha kararlı floresan izotiyosiyanat (FITC) ve rodamin B izotiyosiyanat ile etiketlemeyi başardılar.
1962–1972: Johan Sebastiaan Ploem ve girişim filtresinin tanıtımı
1950'lerde, floresan mikroskobu yalnızca UV, mor veya mavi uyarma ışığı ile yapıldı. Bu yalnızca 1960'larda Hollandalı Johan Sebastiaan Ploem tarafından yönlendirilen girişim filtrelerinin tanıtılmasıyla değişti . Mikroskopide dikroik ışın ayırıcıyı ilk kullananlar, 1953'te Rus Brumberg ve Krylova idi. Ancak, Rusça olarak yayınlanan çalışma Batı'da bilinmiyordu ve ancak daha sonra "yeniden keşfedildi".
İmmünofloresan için çok sayıda antikorun geliştirilmesiyle tahrik edilen farklı renklerde florokromlara ihtiyaç vardı. Bununla birlikte, bunların UV ışığı ile geleneksel kullanım yoluyla uyarılması genellikle zordur. 1962 civarında Ploem, mavi veya yeşil ışığı yansıtan dikroik ışın bölücüler geliştirmek için Mainz'deki Schott çalışmaları ile bir işbirliği başlattı . Schott daha önce floresan mikroskopisinde yaygın olarak kullanılan cam filtrelerin çoğunu üretmişti. Leitz şirketi, Ploem'e yarı saydam, renkten bağımsız bir aynaya sahip opak bir olay ışığı tedarik etti. Bu, Universiteit van Amsterdam'da yeniden inşa edildi ve UV, mor, mavi ve yeşil ile uyarma için dikroik ışın ayırıcılar için dört pozisyonlu bir slayt aldı, böylece ilgili uyarma dalga boyu uygun bir şekilde seçilebilir. İlk kez, bugün alışıldığı gibi, uyarı mercekten geldi. Mavi veya yeşil uyarma ışığı için dar bantlı girişim filtreleri seçerek, immünofloresansta sıklıkla kullanılan FITC (yeşil floresan) ve tetrametilrhodamin izotiyosiyanat (TRITC; turuncu floresan) boyaları, aynı anda büyük olmadan absorpsiyonlarının maksimumlarına yakın bir şekilde uyarılabilir. gereksiz uyarma dalga boylarından kaynaklanan otofloresans miktarları tetiklenir. Ploem, sonuçlarını 1965'ten itibaren çeşitli makalelerde yayınladı.

Leitz daha sonra üzerinde dört ışın ayırıcının dönüşümlü olarak ışın yoluna döndürülebildiği bir cihaz olan PLOEMOPAK'ı geliştirdi. Daha sonraki sürümler, her biri bir uyarma filtresi, ışın ayırıcı ve engelleme filtresi içeren dört floresan filtre küpü içeren 1972 civarında piyasaya sürülene kadar engelleme filtreleri ve uyarma filtreleri ile desteklendi. Küpler, kullanılan florokromlara adapte etmek için kullanıcı tarafından değiştirilebilir.
Bununla birlikte, bugün hala kullanılmakta olan epifloresan mikroskobunun gelişimi prensipte tamamlanmıştır. Ancak, bu tür inşaatların genel kabul görmesi birkaç yıl alacaktır. 1975 ve 1977 tarihli İngiliz mikroskopi ders kitapları yalnızca UV uyarımı ve iletilen ışık aydınlatması olasılığından bahsetmektedir. 1982'den sonraki bir kişi, aydınlatmanın genellikle bir karanlık alan yoğunlaştırıcısı ile yapıldığını söyledi, ancak aynı zamanda, bir dikroik ışın ayırıcı ile gelen ışık aydınlatmasını tanımladı ve onu daha ışığa duyarlı olan olarak sundu. Tüm filtreleri değiştirerek FITC ve rodamin gibi florokromları birbiri ardına tespit edebilme olasılığından da bahsedildi.
1985 tarihli bir Batı Alman ders kitabı, üç olasılığın tümünü açıkladı, iletilen ışık parlak ve karanlık alan ve ayrıca yansıyan ışık parlak alan uyarımı mercek yoluyla, ikincisini özellikle basit bir ayara (yoğunlaştırıcı gerekmediğinden) ve yüksek uyarma yoğunluğuna bağladı. mükemmel kontrastla ve filtre bloklarının hızlı bir şekilde değiştirilebileceğinden bahsetti. Leitz, Olympus , Reichert, Zeiss ve Jena, muhtemelen VEB Carl Zeiss Jena anlamına gelen bu tür sistemlerin üreticileri olarak adlandırıldı . 1988'den bir ders kitabı eski yöntemlerden bahsetti, ancak daha sonra şunu belirtti: "Modern floresan mikroskopları, bir dikroik bölme plakası ile yansıyan ışık parlak alan uyarımı ilkesine göre çalışır". Ayrıca şu belirtildi: "Çoğu mikroskop üreticisi, iletilen ışık ve yansıyan ışık floresan mikroskobu için olanaklar sunar".
İnternet linkleri
- Michael Volger (Ed.: Irene K. Lichtscheidl): Floresans mikroskobu. 25 Mart 2017'de erişildi ( Viyana Üniversitesi'nde pratik uygulama için teorik giriş ve talimatlar. Univie.ac.at (PDF)).
- Floresan Mikroskopisinde Çok Dalgaboylu Epi-Aydınlatması Johan Sebastiaan Ploem ve Leica Science Lab'de Friedrich Walter tarafından yapılmıştır.
- Floresan boya veritabanları: Fluorophores.org , Arizona Üniversitesi'ndeki Spectra Veritabanı , Thermo Fisher'daki Floresan SpectraViewer .
Bireysel kanıt
- ↑ a b Jörg Haus: Optik mikroskopi . Wiley-VCH, Weinheim 2014, ISBN 978-3-527-41127-6 , s. 163-173 .
- ↑ a b c d e f g h i j k l m Guy Cox: Hücre Biyolojisinde Optik Görüntüleme Teknikleri . İkinci baskı CRC Press, Taylor & Francis Group, Boca Raton, FL, USA 2012, ISBN 978-1-4398-4825-8 , s. 35-48 .
- ^ Markus Axmann, Josef Madl, Gerhard J. Schütz: Yaşam Bilimlerinde Tek Molekül Mikroskobu . In: Ulrich Kubitscheck (Ed.): Floresan Mikroskobu . Wiley-Blackwell, Weinheim 2013, ISBN 978-3-527-32922-9 , s. 293-343, burada s. 309 .
- ↑ I.Georgakoudi, BC Jacobson, MG Müller, EE Sheets, K. Badizadegan, DL Carr-Locke, CP Crum, CW Boone, RR Dasari, J. Van Dam, MS field: NAD (P) H and collagen as in vivo epitelyal prekanseröz değişikliklerin kantitatif floresan biyobelirteçleri. In: Kanser araştırması . Cilt 62, Sayı 3, Şubat 2002, sayfa 682-687, PMID 11830520 .
- ^ MR Speicher, S. Gwyn Ballard, DC Ward: Kombinatoryal çoklu flor FISH ile insan kromozomlarının Karyotiplenmesi. İçinde: Doğa genetiği . Cilt 12, Sayı 4, Nisan 1996, sayfa 368-375, doi: 10.1038 / ng0496-368 . PMID 8630489 .
- ↑ A. Bolzer, G. Kreth, I. Solovei, D. Köhler, K. Saracoglu, C. Fauth, S. Müller, R. Eils, C. Cremer, MR Speicher, T. Cremer: Üç boyutlu haritalar insan erkek fibroblast çekirdeklerinde ve prometafaz rozetlerinde kromozomlar. İçinde: PLoS biyolojisi . Cilt 3, sayı 5, Mayıs 2005, s. E157, doi: 10.1371 / journal.pbio.0030157 . PMID 15839726 , PMC 1084335 (ücretsiz tam metin).
- ^ A b Douglas B. Murphy, Michael W. Davidson: Işık Mikroskobu ve Elektronik Görüntülemenin Temelleri . İkinci baskı Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , s. 45-50 .
- ↑ Guy Cox: Hücre Biyolojisinde Optik Görüntüleme Teknikleri . İkinci baskı CRC Press, Taylor & Francis Group, Boca Raton, FL, USA 2012, ISBN 978-1-4398-4825-8 , s. 75-81 .
- ↑ Douglas B. Murphy, Michael W. Davidson: Temelleri Işık Mikroskobu ve Elektronik Görüntüleme . İkinci baskı, Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , s. 389-413 .
- ↑ Rolf Theodor Borlinghaus: Beyaz eş odaklı mikroskopi: Tüm renklerde optik kesitler . Springer Spectrum, 2016, ISBN 978-3-662-49358-8 .
- ^ Ian D. Johnson: Floresan Probların Seçimi ve Uygulamasında Pratik Hususlar . İçinde: James Pawley (Ed.): Biyolojik Konfokal Mikroskopi El Kitabı . 3. Baskı. Springer Science and Business Media LLC, 2006, ISBN 0-387-25921-X , Bölüm 1, s. 353-367 .
- ^ A b Douglas B. Murphy, Michael W. Davidson: Işık Mikroskobu ve Elektronik Görüntülemenin Temelleri . İkinci baskı Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , s. 361-365 .
- ↑ a b c Gerd Ulrich Nienhaus, Karin Nienhaus: Floresan Etiketleme . In: Ulrich Kubitscheck (Ed.): Floresan Mikroskobu . Wiley-Blackwell, Weinheim 2013, ISBN 978-3-527-32922-9 , s. 143-173, burada s. 147-148 .
- ↑ Douglas B. Murphy, Michael W. Davidson: Temelleri Işık Mikroskobu ve Elektronik Görüntüleme . İkinci baskı, Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , s. 227 f .
- ↑ a b Guy Cox: Hücre Biyolojisinde Optik Görüntüleme Teknikleri . İkinci baskı CRC Press, Taylor & Francis Group, Boca Raton, FL, USA 2012, ISBN 978-1-4398-4825-8 , s. 181-190 .
- ↑ Guy Cox: Hücre Biyolojisinde Optik Görüntüleme Teknikleri . İkinci baskı CRC Press, Taylor & Francis Group, Boca Raton, FL, USA 2012, ISBN 978-1-4398-4825-8 , s. 169-180 .
- ↑ Douglas B. Murphy, Michael W. Davidson: Temelleri Işık Mikroskobu ve Elektronik Görüntüleme . İkinci baskı, Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , s. 167 .
- ^ Ashley R. Clarke, Colin Nigel Eberhardt: Malzeme Bilimi için Mikroskopi Teknikleri . Woodhead Publishing, Abington Hall 2002, ISBN 978-1-85573-587-3 , s. 255, 279-284 .
- ^ LA Donaldson: Mikroskopi kullanarak lif analizi . İçinde: Tekstil Elyaf Yapısı El Kitabı. Temeller ve Üretilen Polimer Elyaflar. Tekstilde Woodhead Yayıncılık Serisinde Cilt 1 . 2018 Elsevier, 2009, s. 121–153 , doi : 10.1533 / 9781845696504.1.121 ( alıntı ).
- ^ Pankaj Kumar: Organik Güneş Pilleri: Cihaz Fiziği, İşleme, Bozunma ve Önleme . CRC Press, 2016, ISBN 978-1-4987-2327-5 , s. 23 ( Google Kitaplar ).
- ↑ JH Huang, FC Chien, P. Chen, KC Ho, CW Chu: Eş odaklı ömür boyu görüntüleme kullanarak toplu heterojonksiyon polimer güneş pillerinin 3B nano yapılarını izleme. İçinde: Analitik Kimya . Cilt 82, Sayı 5, Mart 2010, sayfa 1669-1673, doi: 10.1021 / ac901992c , PMID 20143827 .
- ↑ A. Ummadisingu, L. Steier, JY Seo, T. Matsui, A. Abate, W. Tress, M. Grätzel: Metal halojenür perovskit filmlerin oluşumunda aydınlatmanın etkisi. İçinde: Doğa . Cilt 545, sayı 7653, 05 2017, sayfa 208-212, doi: 10.1038 / nature22072 , PMID 28445459 .
- ^ FWD Rost: Floresan Mikroskobu Cilt II . Cambridge University Press, 1995, ISBN 978-0-521-41088-5 , s. 40–47 ( Google Kitaplar'da çevrimiçi ).
- ↑ a b c d e Jörg Haus: Optik mikroskopi . Wiley-VCH, Weinheim 2014, ISBN 978-3-527-41127-6 , s. 189-200 .
- ↑ Guy Cox: Hücre Biyolojisinde Optik Görüntüleme Teknikleri . İkinci baskı CRC Press, Taylor & Francis Group, Boca Raton, FL, USA 2012, ISBN 978-1-4398-4825-8 , s. 63 ff .
- ↑ Guy Cox: Hücre Biyolojisinde Optik Görüntüleme Teknikleri . İkinci baskı CRC Press, Taylor & Francis Group, Boca Raton, FL, USA 2012, ISBN 978-1-4398-4825-8 , s. 109 ff .
- ↑ Guy Cox: Hücre Biyolojisinde Optik Görüntüleme Teknikleri . İkinci baskı CRC Press, Taylor & Francis Group, Boca Raton, FL, USA 2012, ISBN 978-1-4398-4825-8 , s. 223 ff .
- ↑ Harald Bornfleth, Kurt Satzler, Roland Eils, Christoph Cremer: Üç boyutlu konfokal floresan mikroskobunda çözünürlük sınırına yakın ve altındaki nesnelerin yüksek hassasiyetli mesafe ölçümleri ve hacim koruyucu segmentasyonu . İçinde: Mikroskopi Dergisi . bant 189 , hayır. 2 , Şubat 1998, s. 118 , doi : 10.1046 / j.1365-2818.1998.00276.x .
- ↑ Steffen Dietzel, Roland Eils, Kurt Sätzler, Harald Bornfleth, Anna Jauch, Christoph Cremer, Thomas Cremer: İnaktif İnsan X-Kromozom Bölgesinin Döngülü Bir Yapısına Karşı Kanıt . In: Deneysel Hücre Araştırması . bant 240 , hayır. 2 , Mayıs 1998, s. 187 , doi : 10.1006 / excr.1998.3934 , PMID 9596991 .
- ↑ Anonim: 2008 Yılın Yöntemi. İçinde: Doğa Yöntemleri . 6, 2009, s. 1, doi: 10.1038 / nmeth.f.244 .
- ↑ Volker Westphal Silvio O. Rizzoli, Marcel A. Lauterbach Dirk Kamin Reinhard Jahn, Stefan W. Hell : Video Hızı uzak alan Optik Nanoscopy dissects Sinaptik Vezikül Hareketi . İçinde: Bilim . bant 320 , hayır. 5873 , 11 Nisan 2008, s. 246-249 , doi : 10.1126 / science.1154228 .
- ↑ Guy Cox: Hücre Biyolojisinde Optik Görüntüleme Teknikleri . İkinci baskı CRC Press, Taylor & Francis Group, Boca Raton, FL, USA 2012, ISBN 978-1-4398-4825-8 , s. 245-247 .
- ↑ Guy Cox: Hücre Biyolojisinde Optik Görüntüleme Teknikleri . İkinci baskı CRC Press, Taylor & Francis Group, Boca Raton, FL, USA 2012, ISBN 978-1-4398-4825-8 , s. 207 ff .
- ↑ Douglas B. Murphy, Michael W. Davidson: Temelleri Işık Mikroskobu ve Elektronik Görüntüleme . İkinci baskı, Wiley-Blackwell, Hoboken, NJ, USA 2013, ISBN 978-0-471-69214-0 , s. 280 ff .
- ↑ a b Guy Cox: Hücre Biyolojisinde Optik Görüntüleme Teknikleri . İkinci baskı CRC Press, Taylor & Francis Group, Boca Raton, FL, USA 2012, ISBN 978-1-4398-4825-8 , s. 213 ff .
- ↑ a b Guy Cox: Hücre Biyolojisinde Optik Görüntüleme Teknikleri . İkinci baskı CRC Press, Taylor & Francis Group, Boca Raton, FL, USA 2012, ISBN 978-1-4398-4825-8 , s. 201 ff .
- ↑ a b c d e f g h i j k l Dieter Gerlach: Mikroskopi tarihi . Verlag Harri Deutsch, Frankfurt am Main 2009, ISBN 978-3-8171-1781-9 , s. 625-657 .
- ↑ a b c Oskar Heimstädt: Floresans mikroskobu . İçinde: Bilimsel Mikroskopi Dergisi . bant 28 , 1911, s. 330-337 ( çevrimiçi ).
- ↑ a b c Fritz Bräutigam, Alfred Grabner: Fluoreszenzmikoskopie . İçinde: Fritz Bräutigam, Alfred Grabner (ed.): Floresan mikroskobuna katkılar (= "Mikroskopi" dergisinin 1. özel cildi ). Verlag Georg Fromme & Co., Viyana 1949, s. 25-34 .
- ↑ Michail Tswett: Reichert'in floresan mikroskobu ve onunla klorofil ve siyanofil hakkında yapılan bazı gözlemler hakkında. In: Alman Botanik Derneği Raporları . Cilt 29, 1911, s. 744-746. ( çevrimiçi - Gerlach, 2009'dan alıntı.)
- ^ Stanislaus von Prowazek: Hücrelerin floresansı. - Reicherts floresan mikroskobu. İçinde: Zoologischer Anzeiger . Cilt 42, 1913, s. 374-380. ( çevrimiçi - Gerlach, 2009'dan alıntı.)
- ↑ a b c d Max Haitinger: Floresan mikroskobu - histoloji ve kimyadaki uygulamanız . Akademik Yayıncılık Şirketi, Leipzig 1938.
- ^ Karl Höfler : Max Haitinger 1868-1946 . In: Hugo Freund, Alexander Berg (ed.): Uygulamalı doğa bilimleri ve teknoloji (= mikroskopi, yaşam ve büyük araştırmacıların çalışmalarının tarihçesi . Hacim III ). Umschau Verlag, Frankfurt am Main 1966, s. 187-194 .
- ^ Albert H. Coons, Hugh J. Creech, R. Norman Jones, Ernst Berliner: Floresan Antikor Kullanımı ile Dokularda Pnömokokal Antijenin Gösterilmesi . In: J Immunol . bant 45 , hayır. 3 , 1 Kasım 1942, s. 159-170 ( çevrimiçi ).
- ↑ JL Riggs, RJ Seiwald, JH Burckhalter, CM Downs, TG Metcalf: İmmün serum için floresan etiketleme ajanları olarak izotiyosiyanat bileşikleri. In: Amerikan Patoloji Dergisi . Cilt 34, Sayı 6, Kasım-Aralık 1958, sayfa 1081-1097. PMID 13583098 , PMC 1934794 (ücretsiz tam metin).
- ↑ ES Perner: Floresan mikroskopi yöntemleri . İçinde: Hugo Freund (Ed.): Optik temeller, teknolojide mikroskopi için aletler ve yardımcı cihazlar. Bölüm 1: İletilen ışık mikroskobunun genel araçları (= teknolojide mikroskopi kılavuzu . Hacim 1 , bölüm 1). Umschau Verlag, Frankfurt am Main 1957, s. 357-431, burada s.371 .
- ↑ Heinz Appelt: Mikroskobik inceleme yöntemlerine giriş . 4. baskı. Akademik yayın şirketi Geest & Portig, Leipzig 1959, s. 283 .
- ↑ EM Brumberg, TN Krylova: O fluoreschentnykh mikroskobik opak . İçinde: Zh. obshch. biol. 14, 1953, sayfa 461.
- ↑ a b Johan Sebastiaan Ploem, Friedrich Walter: Floresan Mikroskobunda çok dalga boylu epi-aydınlatma . In: Leica Microsystems (Ed.): Scientific and Technical Information CDR . bant 5 , 2001, s. 1–16 ( Leica Science Lab'de çevrimiçi ).
- ^ HN Southworth: Modern Mikroskopiye Giriş . Wykeham Publications LTD, Taylor & Francis Group'un bir üyesi, Londra 1975, ISBN 0-85109-470-8 , s. 84-85 .
- ↑ W. Burrels: Mikroskop Tekniği. Genel ve Uygulamalı Mikroskopi için Kapsamlı Bir El Kitabı . Yeni gözden geçirilmiş basım Fountain Press, Londra 1977, ISBN 0-85242-511-2 , s. 481-483 .
- ↑ Michael Spencer: Işık mikroskobunun temelleri (= IUPAB Biophysics Series . Volume 6 ). Cambridge University Press, Cambridge, İngiltere 1982, ISBN 0-521-28967-X , pp. 40-45 .
- ↑ Dieter Gerlach: Işık mikroskobu. Biyoloji ve tıpta işlev ve uygulamaya giriş . 2. Baskı. Thieme Verlag, Stuttgart 1985, ISBN 3-13-530302-0 , s. 210-224 .
- ↑ Gerhard Göke: Modern ışık mikroskobu yöntemleri: iletilen aydınlık parlak alandan lazer mikroskobuna . Franckh'sche Verlagshandlung, Stuttgart 1988, ISBN 3-440-05765-8 , s. 211-212 .